Les membres de l’Afas publient régulièrement des articles. Ils sont à retrouver ici :
Alain Delacroix
Professeur honoraire, chaire "Chimie industrielle - Génie des procédés" du Conservatoire national des arts et métiers

Face au 103 du boulevard Saint-Michel se trouve la Fontaine de la guérison, érigée à la gloire de Pierre Joseph Pelletier et Joseph Bienaimé Caventou. Sur le dessus figure une femme nue allongée, du sculpteur Pierre-Marie Poisson, qui remplace les statues d’Edouard Lormier fondues en 1942.
Ce sont ces deux chimistes pharmaciens qui ont isolé la quinine, célèbre médicament contre le paludisme, à partir de l’écorce de certains quinquinas. Leurs travaux ont été communiqués à l’Académie de médecine il y a deux cents ans, les 11 septembre et 16 octobre 1820.
Joseph Pelletier est le descendant de chimistes et de pharmaciens. Son père, Bertrand Pelletier, né à Bayonne en 1761, est décédé jeune à Paris en 1797. C’est un savant reconnu qui est nommé membre de l’Académie des Sciences en 1792. Il achète, en 1784, une pharmacie parisienne créée en 1750 par le célèbre Rouelle. Cette pharmacie, du temps de Pelletier, se trouvait à l’actuel 45 rue Jacob (qui était numéroté 43 avant un décret de 1847). Elle a ensuite déménagé en face, au numéro 48, et elle existe toujours. Cette pharmacie sera reprise par madame veuve Pelletier en 1797. C’est là que naît Joseph Pelletier le 22 mars 1788.
Joseph Pelletier obtient en 1810 son diplôme de l’Ecole de pharmacie et reprend la pharmacie de ses parents. Docteur en sciences en 1812, il est nommé, dès 1815, professeur adjoint à l’Ecole de pharmacie.
En 1817, il décrit l’émétine à partir de la racine d’ipéca. Peu après, il fait la connaissance de Joseph Caventou et, ensemble, ils vont extraire, en 1818, la strychnine (à partir de la noix vomique), en 1819, la brucine et la vératrine (à partir du même végétal), en 1820, la cinchonine et la quinine (à partir d’écorce de quinquina) et, en 1821, la caféine. Toujours avec Caventou, il va créer une usine pour produire la quinine afin de traiter le paludisme et ils publient leur procédé.
A la suite de ces travaux reconnus, Pelletier est nommé membre du Conseil de la salubrité de Paris de 1821 à 1849. Il devient professeur à l’Ecole de pharmacie en 1825, puis son directeur adjoint en 1832. En 1827, il est président de la Société de pharmacie et devient membre de l’Académie de médecine lors de sa fondation en 1820. Enfin, il est promu officier de la Légion d’honneur en 1828.
Joseph Pelletier décède le 19 juillet 1842 et est inhumé au cimetière du Montparnasse à Paris.
Joseph Bienaimé Caventou est né en 1795. Son père est pharmacien aux Armées de la République et détaché à l’hôpital militaire. C’est là que Joseph Caventou commence ses études de pharmacie et, de mai à septembre 1815, il est appointé comme pharmacien. En 1816, il entre à l’hôpital Saint-Antoine à Paris, où il dispose d’un laboratoire de recherche. A la fin de son internat, il publie avec son chef de service la traduction d’un livre en allemand et, à seulement 21 ans, une nouvelle nomenclature chimique d’après la classification de Thénard.
Joseph Caventou fait alors la connaissance de Pelletier, son aîné de sept ans, avec qui il va faire les nombreuses recherches vues plus haut. Ces travaux le font nommer, en 1821, dans la section de pharmacie de l’Académie royale de médecine que Louis XVIII vient de créer à la demande du baron Portal.
Comme Pelletier, Caventou va posséder une pharmacie. Celle-ci sera située rue Gaillon à Paris.
Le 18 juillet 1830, un décret de Charles X le nomme professeur adjoint à l’Ecole de pharmacie. Le 7 janvier 1834, une ordonnance royale de Louis-Philippe crée deux cours à l’Ecole de pharmacie, dont un en toxicologie. Caventou devient titulaire de ce cours de 1834 à 1859. La mort prématurée de Pelletier va le marquer profondément et sa production scientifique diminue dès 1842.
L’activité de Caventou concernant la toxicologie s’est manifestée lors d’un procès retentissant : le 19 septembre 1840, Marie Capelle, veuve Lafarge, est reconnue coupable (avec circonstances atténuantes !) d’avoir empoisonné son mari à l’arsenic et est condamnée, à Tulle, aux travaux forcés à perpétuité. C’est grandement en raison des conclusions du célèbre Orfila, auteur du Traité des poisons, que la veuve est condamnée, alors que Raspail les conteste. Suite à cette querelle d’experts, les Académies des sciences et de médecine vont nommer une commission dont Caventou est le rapporteur. Son rapport intitulé Les moyens de constater la présence d’arsenic dans les empoisonnements par ce toxique ne permettra pas de calmer les débats. Il est curieux de constater qu’un cas voisin s’est produit une centaine d’années plus tard avec «la bonne dame de Loudun», où, sur le même sujet, la même querelle d’experts a fait rage.
Joseph Caventou demande sa mise à la retraite à 64 ans, ce qui est tôt pour l’époque, et il est nommé professeur honoraire par décret impérial du 2 décembre 1859. Il partage alors sa vie entre l’Ecole, sa maison de campagne de Saint-Mandé, sa maison de famille à Saint-Omer et son «chalet» de Saint-Valery-sur-Somme. Il décède à Paris le 5 mai 1877 et est inhumé à Saint-Mandé.
Pelletier et Caventou, en tant que pharmaciens, vont se lancer très tôt après leur découverte dans la fabrication industrielle de la quinine. En 1826, ils produisent 1800 kg de sulfate de quinine à partir de 138 tonnes d’écorces de quinquina. Toutefois, en rendant public leur procédé – ce qui est généreux –, ils vont participer à la fortune de l’industrie pharmaceutique allemande et américaine. Cela rappelle un peu le don des brevet français à la communauté internationale par les révolutionnaires français, qui fera les beaux jours de l’industrie chimique anglaise grâce au procédé Leblanc !
L’isolement de la molécule de quinine constitue un grand progrès dans le traitement du paludisme, qui fait, aujourd’hui toujours, 400 000 morts par an. Avant la découverte de Pelletier et Caventou, on broyait les écorces de quinquina et la dose de quinine donnée au malade était très variable en fonction de la qualité du quinquina. Il était alors impossible de relier la dose à l’effet et on pouvait être soit inefficace, soit dépasser la dose toxique. A partir de 1820, on a pu alors prescrire le médicament à sa dose optimale. Toutefois, la toxicité de la quinine a induit de nombreuses recherches afin de trouver d’autres molécules présentant moins de risques. C’est ainsi qu’on a mis sur le marché les célèbres chloroquine et hydroxychloroquine.
Jeanne Brugère-Picoux
Professeur honoraire de pathologie médicale du bétail et des animaux de basse-cour (Ecole nationale vétérinaire d’Alfort), membre de l’Académie nationale de médecine, présidente honoraire de l’Académie vétérinaire de France

L’annonce, le 27 mars, d’un nouvel animal de compagnie positif à la Covid-19, un chat résidant en Belgique et vivant dans l’entourage d’une femme touchée par le Sars-CoV-2, suivi le 3 avril d’un autre cas chez un chat chinois, repose la question du risque potentiel de transmission du virus entre l’animal de compagnie et l’Homme. Les quatre cas dépistés jusqu’à présent ne permettent pas, actuellement, de conclure à une infection productive favorisant une éventuelle contagiosité animal-Homme ou animal-animal. Ils ne remettent pas en question les recommandations déjà formulées quand un animal vit dans l’entourage d’un malade.
Chats et chiens contaminés par leur propriétaire Covid-19 positif
Nous avions déjà signalé qu’il était fort peu probable que l’agent de la Covid-19, le Sars-CoV-2, soit transmissible de l’animal vers l’Homme alors que l’observation de deux chiens positifs à Hong Kong témoignait de la possibilité d’une contamination d’un propriétaire infecté vers son animal.
L’annonce, le 27 mars, de la contamination d’un chat en Belgique témoigne une fois de plus de cette possibilité de transmission du virus de l’Homme lors d’un contact étroit avec l’animal. Depuis, après les deux chiens, un second chat a été déclaré positif à Hong Kong le 3 avril 2020 [1].
Mais peut-on parler de risque zoonotique de l’animal vers l’Homme face à ces cas exceptionnels ?
Le premier chien de Hong Kong était un Loulou de Poméranie âgé (17 ans), mis en quarantaine le 26 février et sans signes cliniques. Les prélèvements nasaux et oraux se sont révélés faiblement positifs pour la recherche de l’ARN viral par RT-PCR à cinq reprises, puis les derniers prélèvements se sont révélés négatifs. Les prélèvements rectaux ont été négatifs.
Ce chien est mort deux jours après son retour de quarantaine chez sa propriétaire, le 16 mars, à la suite de déficiences rénales et cardiaques. Et ce n’est qu’après ce décès, le 26 mars, que l’on a appris que la recherche d’anticorps sur un prélèvement sanguin, du 3 mars, s’était révélée finalement positive. Du fait des faibles valeurs de PCR, on peut penser que l’infection développée par le chien a été trop faiblement productive pour attester d’un risque de contagiosité.
Le second chien positif de Hong Kong est un berger allemand âgé de 2 ans envoyé en quarantaine depuis le 18 mars 2020 avec un chien négatif de race mixte de la même résidence. Comme le cas précédent, il a été contaminé par son propriétaire et révélé positif lors de la recherche de l’ARN viral en RT-PCR, les 19 et 20 mars, mais sans présenter de symptômes. Les données concernant ce deuxième cas ne permettent pas de conclure à une infection productive.
Le troisième cas concerne un chat belge diagnostiqué positif à la faculté de médecine vétérinaire de l’université de Liège, le 18 mars. Ce cas a été annoncé, le 27 mars, par le Comité scientifique (SciCom) institué auprès de l’Agence fédérale pour la sécurité de la chaîne alimentaire (Afsca), qui a d’ailleurs émis un avis provisoire sur le risque zoonotique associé aux animaux de compagnie [2].
Le chat vivait chez sa propriétaire atteinte de la Covid-19 après un voyage en Italie et confinée à son domicile. Il a présenté des symptômes (anorexie, diarrhée, vomissements, toux et respiration superficielle) une semaine après le retour de sa propriétaire.
Les prélèvements de liquides gastriques et de matières fécales se sont révélés positifs en PCR. Dix jours plus tard, l’état du chat s’est amélioré mais d’autres examens n’ont pu être réalisés du fait du confinement du chat et de la propriétaire.
Selon le SciCom, il n’est pas possible de conclure à une infection virale productive mais elle peut être suspectée du fait des symptômes compatibles avec une coronavirose. Mais le chat peut aussi avoir été un vecteur passif du fait de la forte contamination de l’environnement liée à sa propriétaire infectée et confinée.
Le quatrième cas concerne un chat de Hong Kong déclaré le 3 avril 2020 à l’Organisation mondiale de la santé animale (OIE). Il a été placé sous quarantaine le 30 mars à la suite de l’hospitalisation de son maître contaminé par la Covid-19. Tous les échantillons (nasaux, cavité buccale, fèces) ont été positifs au Sars-CoV-2, de même que le 1er avril pour des écouvillons nasaux et oraux. Ce chat reste sous surveillance.
Recherches sérologiques
Ces quatre cas ne permettent pas, actuellement, de conclure à une infection productive favorisant une éventuelle contagiosité animal-Homme ou animal-animal.
Par ailleurs, les laboratoires Idexx [3] ont mis au point récemment un test de diagnostic Idexx Sars-Cov-2 (Covid-19) RealPCR test ND.
Ce test a été réalisé sur près de 4000 échantillons respiratoires (77%) ou fécaux (23%), récoltés entre le 24 février et le 12 mars 2020 dans 50 Etats américains et en Corée du Sud où il existait des cas humains de Covid-19.
Plusieurs animaux de compagnie ont été testés : chiens (55%), chats (41%) et chevaux (4%). Tous les tests se sont révélés négatifs.
Une autre enquête sérologique (ELISA) a été réalisée en Chine chez des chats de Wuhan prélevés avant et après l’épidémie de Covid-19 [4]. Sur les 102 chats prélevés après l’épidémie de Covid-19, 15 (soit 14,7%) se sont révélés positifs, dont 11 avec des titres d’anticorps neutralisants variant de 1/20 à 1/1080, les taux les plus importants ayant été relevés chez les trois chats dont les propriétaires étaient Covid-19 positifs (1/360, 1/360 et 1/1080). Les autres chats étaient des chats errants ou présents dans des hôpitaux. Les chats témoins ayant été prélevés avant l’épidémie étaient négatifs.
Une étude sur une plus large échelle dans d’autres pays très affectés est nécessaire pour confirmer que le Sars-CoV-2 ne circule pas chez nos animaux de compagnie pendant une période d’épidémie importante.
Reproductions expérimentales de la Covid-19 chez des animaux de compagnie
L’éditorial de la revue Nature du 1er avril 2020 rapporte les résultats des travaux réalisés par une équipe chinoise de l’institut de recherche vétérinaire de Harbin [5] démontrant que l’on pouvait reproduire expérimentalement par inoculation intranasale l’infection par des virus Sars-CoV-2 chez des animaux pouvant être de compagnie ou de ferme (furets, chats, chiens, poulets, porcs et canards). Il faut noter que dans ce document prépublié (n’ayant pas encore fait l’objet d’une validation), seul un petit nombre d’animaux ont été inoculés avec des fortes doses de virus.
Le virus a été détecté dans les premières voies respiratoires des furets, qui n’ont pas présenté de symptômes importants ou une mortalité.
Cinq chats ont pu être infectés, avec une excrétion virale dans les échantillons respiratoires et fécaux et une séroconversion. Il a été possible de démontrer que le virus pouvait être transmis par la voie aérienne sur l’un des trois chats en contact avec les chats inoculés.
Les trois chiens inoculés ont montré une très faible sensibilité à l’infection virale.
Enfin les porcs, les poulets et les canards ne se sont pas révélés sensibles.
Rappelons que des études antérieures sur le Sras-CoV à l’origine du syndrome respiratoire aigu sévère (Sras) avaient déjà montré expérimentalement que les chats pouvaient être infectés et contaminer d’autres chats sans que l’on ait montré un rôle épidémiologique des chats dans ce syndrome.
Dans une seconde publication du 31 mars [6], une équipe sud-coréenne rapporte l’inoculation expérimentale de furets avec de fortes doses de virus. Chez ces furets, on a pu retrouver le virus dans les cavités nasales, la salive, l'urine et les fèces jusqu'à huit jours suivant l’inoculation. Il a été aussi possible de démontrer une contagiosité chez des furets placés en contact direct dans la même cage que les furets inoculés. Pour quelques furets en contact indirect car placés dans des cages séparées, on a pu aussi démontrer la possibilité d’une transmission par la voie aérienne. Par comparaison avec les inoculations réalisées avec le Sars-CoV du Sras, les auteurs font remarquer que les aspects cliniques et les titres de virus dans les poumons sont plus faibles avec le Sars-CoV-2 mais que l’infection persiste plus longtemps chez l’animal, avec la possibilité d’un portage asymptomatique permettant la propagation du virus. Le furet peut néanmoins être un modèle animal pour l’étude de l’infection par le Sars-CoV-2 comme dans le cas de plusieurs viroses respiratoires humaines (virus influenza ou parainfluenza, virus respiratoire syncytial, Sars-CoV-1). Ce document prépublié ne concerne que 24 furets et n’a pas encore fait l’objet d’une validation.
D’autres tests sont nécessaires, notamment chez les chats avec des doses différentes de virus pour vérifier la possibilité de cette transmission par contact.
Mesures de biosécurité
Ces observations ne modifient pas les recommandations que nous avions formulées et montrent qu’il est inutile d’alarmer les propriétaires d’animaux de compagnie car le principal risque de la Covid-19 est une transmission interhumaine. Il n’est pas nécessaire de séparer les animaux de la famille lorsqu’une personne est Covid-19 positive dans le milieu familial mais il faut renforcer les mesures de biosécurité habituellement recommandées pour éviter les zoonoses liées aux animaux de compagnie, notamment le lavage des mains, l’entretien de la litière ou l’apport des aliments tout en évitant un contact à risque avec l’animal (baisers, léchage, partage de la nourriture, notamment).
Par conséquent, l’important est, lorsque la personne infectée est maintenue à domicile, de réduire au maximum les possibilités de contacts de l’animal avec celle-ci et de désinfecter son environnement. Il faut aussi recommander qu’une autre personne vivant sous le même toit s’occupe de l’animal.
Réalisation de tests par les laboratoires vétérinaires
La réalisation de tests Covid-19 par les laboratoires vétérinaires accrédités COFRAC est envisagée par le ministère de la Santé et sera nécessaire pour permettre de lever le confinement actuel.
Dans le contexte exceptionnel de la crise sanitaire liée à la pandémie actuelle de Covid-19, ces tests doivent être effectués en priorité pour le suivi des cas humains en France comme dans d’autres pays européens, mais il faut aussi souhaiter la possibilité d’une vigilance vétérinaire accrue du risque de contamination des animaux de compagnie, voire de ferme, par le Sars-CoV-2 dans le contexte «Une seule santé».
https://www.oie.int/wahis_2/public/wahid.php/Reviewreport/Review/viewsummary?fupser=&dothis=&reportid=33455
https://www.oie.int/wahis_2/public/wahid.php/Reviewreport/Review/viewsummary?fupser=&dothis=&reportid=33684
https://www.oie.int/wahis_2/public/wahid.php/Reviewreport/Review/viewsummary?fupser=&dothis=&reportid=33832
[2] https://urlz.fr/cfa1.
[3] https://urlz.fr/cfa7.
[4] Zhang Q et al. SARS-CoV-2 neutralizing serum antibodies in cats: a serological investigation. https://doi.org/10.1101/2020.04.01.021196 (prépublication non validée).
[5] Jianzhong Shi et al. Susceptibility of ferrets, cats, dogs, and different domestic animals to SARS-coronavirus-2. bioRxiv preprint 2020.03.30.015347v1.full.pdf
[6] Young-Il Kim et al. Infection and rapid transmission of SARS-CoV-2 in ferrets. Journal pre-proof. CellPress.DOI: 10.1016/j.chom.2020.03.023.
Patrice Debré
Professeur émérite d’immunologie à Sorbonne Université, membre de l’Académie nationale de médecine
Les microbes sont responsables de 25% des décès (14 millions de morts), dont les deux tiers sont des enfants, atteignant principalement les pays à ressources limitées. En même temps, ils vivent en nous, avec nous, pour nous, en germes commensaux de l’homme : c’est le microbiote.
Le terme microbiote désigne l'ensemble des microbes qui habitent l'homme et cohabitent avec lui, quelle que soit leur localisation anatomique, sur la peau, dans le conduit auditif, les bronches, la cavité vaginale, etc. [1, 2]. Les recherches sur le microbiote ont cependant essentiellement porté sur les bactéries et leur présence dans le tube digestif, où l’on en trouve le plus grand nombre, mais aussi parce c'est là que leur influence sur la physiologie de l'organisme semble déterminante.
Il y a 100 milliards de bactéries dans un gramme de selles, autant que de cellules qui constituent notre cerveau, même si les neurones sont de plus grande taille. Entre la bouche et l’anus, sur une surface considérable de près de 400 m2, plusieurs centaines de milliards de bactéries cohabitent, sans compter les virus et les champignons. Les microbes qui habitent l’homme ont ainsi fait la conquête d’un autre environnement. Les effets heureux de la sélection naturelle ont sans doute aussi apporté leur contribution à l’humanité en passant du parasitisme agressif à la symbiose. Hommes, animaux ou plantes abritent, depuis leur apparition sur terre, des virus, bactéries ou champignons qui leur préexistaient et dont ils assurent, de manière asymétrique, l’habitat, la nourriture, parfois la défense. Au fur et à mesure de l’évolution, l’inverse s’est pourtant produit. L’hôte exige la réciprocité. On passe alors à un état de mutualisme ou de symbiose, forme sans doute la plus aboutie de la co-évolution.
Les territoires et fonctions du microbiote digestif
La bouche héberge plus de 320 espèces différentes de bactéries commensales, réparties entre la salive, les lèvres, les joues, le palais, la langue, les dents et la gencive. Plusieurs millions de germes sont présents par millilitre de salive. Des espèces peuvent encore y être découvertes. La plus célèbre des bactéries qui prolifèrent dans l’œsophage et l’estomac est Helicobacter pylori, seule capable de survivre en milieu aussi acide, mais aussi de donner des ulcères. Si l'on poursuit l'étude des bactéries du tube digestif, dans la dernière partie de l’intestin grêle, l’iléon, vit une population plus importante de microbes, de l’ordre de 100 millions de bactéries par gramme de matière, qui fait de ces dernières la part essentielle de ce qu’on peut y trouver. La flore y est cependant assez mal définie car son examen nécessite des prélèvements par chirurgie ou intubation, mais sa diversité est proche de celle observée dans les selles. Dans le côlon, la diversité et le nombre des bactéries sont considérables, mille fois supérieurs à leur concentration dans l’iléon. La moitié de la matière qui constitue les selles correspond à des bactéries. Seules subsistent les anaérobies strictes. Ainsi les bactéries Escherichia coli, qui se sont ainsi adaptées à la vie sans oxygène, y prolifèrent.
Le microbiote est unique à chacun de nous, même s’il comporte une grande diversité (cf. figure). Deux grands groupes bactériens dominent : les firmicutes et les bactéroïdes. Ces deux grandes populations correspondent à plus de 80% des bactéries de notre intestin. Pourtant elles divergent presque autant que les règnes animal et végétal. Les firmicutes représentent une espèce qui comprend des germes très courants et connus comme le staphylocoque ou le streptocoque. D’autres, comme le Lactobacillus bulgaris, sont moins connus. Les bactéroïdes représentent le groupe le plus important de bacille à Gram négatif. Ils sont essentiellement anaérobies. Si plus de 250 espèces ont ainsi été identifiées dans ces deux phylums majeurs, il existe de nombreuses autres bactéries dans la microflore. Elles appartiennent majoritairement à deux autres groupes, les Actinobacteria et les Proteobacteria, parmi lesquelles des bactéries réductrices de soufre. Mais on trouve aussi des archéobactéries.
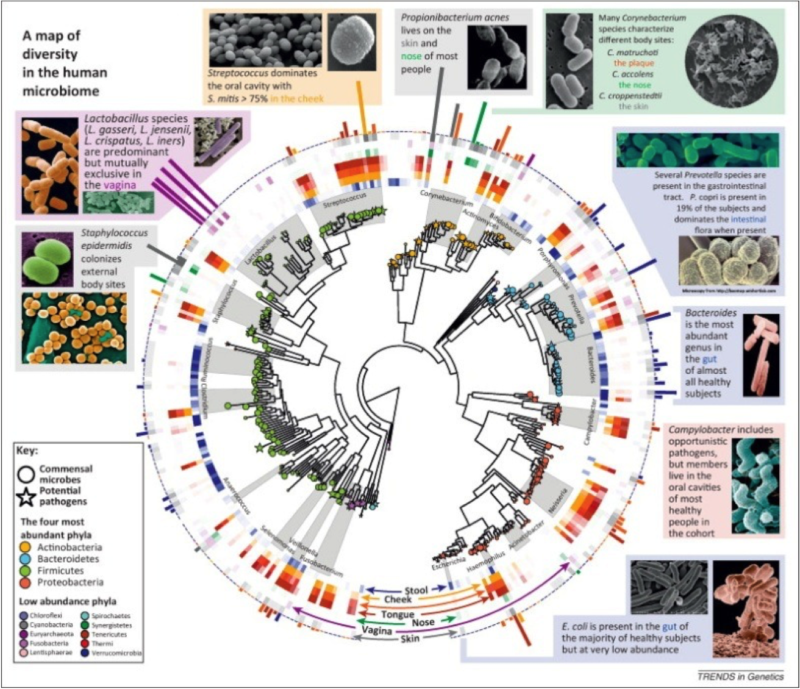
Les deux tiers des espèces intestinales dominantes qu’héberge chaque individu adulte lui sont totalement spécifiques. Le tiers restant étant plus ou moins partagé selon les individus. Bien entendu, cet équilibre dépend de l’alimentation, de la prise d’antibiotiques, de l’hygiène. Chez un même individu, les grands équilibres entre espèces varient cependant peu, malgré les éventuelles modifications de régime alimentaire. La flore intestinale reste difficile à étudier. Il faut en effet la prélever. Aussi se réfère-t-on plus facilement au microbiote fécal que cæcal, malgré les différences entre les deux. Il y a quelques années, l’analyse ne pouvait être fondée que sur les techniques de culture qui, selon leur composition, permettaient une sélection par genre ou espèce, ou au contraire leur prolifération en masse. Aux critères de forme phénotypique et de caractérisation du métabolisme bactérien sont venues s’adjoindre aujourd'hui les données de la génomique qui ont permis l'analyse simultanée de l’ensemble des populations microbiennes, la métagénomique.
Né stérile – sa condition in utero –, le nouveau-né se trouve propulsé dans un univers microbien riche et varié, celui de sa mère. De manière étonnante cependant, malgré l’extraordinaire diversité des microbes maternels, il est colonisé de façon rapide et massive par un microbiote relativement simple qui va se modifier par l’allaitement. D’autres éléments influencent encore l’implantation et la composition de la flore intestinale : le mode d’accouchement, l’environnement, le type d’alimentation, l’âge à la naissance et l’antibiothérapie.
Le microbiote a deux grandes fonctions principales, capitales pour l’homme : il permet la digestion de l’amidon et des sucres complexes des fibres alimentaires ; il joue un rôle dans l’activation, la différenciation et l’homéostasie du système immunitaire, lui permettant de tolérer les microbes commensaux et d’éliminer les pathogènes.
Le microbiote permet la digestion de l’amidon et des sucres complexes des fibres alimentaires
Une part importante de l’amidon se déverse dans le côlon sans avoir été préalablement transformé. Cette portion, qu’on appelle amidon résistant, sert à la prolifération des bactéries qui transforment les aliments amidonnés et permettent leur absorption. Les fibres alimentaires se déversent dans le gros intestin où elles se trouvent confrontées à de très nombreuses enzymes bactériennes différentes, capables de détruire tous les sucres des grains, tubercules, rhizomes, fruits. Les bactéries ne s’attaquent cependant pas qu’aux sucres alimentaires, elles digèrent aussi le mucus. Sans bactéries, le mucus, qui est continuellement secrété et jusqu’à des quantités considérables, entraînerait une distension colique, comme cela est observé chez les souris axéniques ou chez les hommes qui vivent sans germes. La dégradation par le microbiote des protéines présentes dans le côlon génère de nombreuses substances métaboliques potentiellement toxiques pour l’hôte. Elles sont dégradées en peptides, qui sont la principale source azotée du gros intestin. Cette hydrolyse est indispensable aux bactéries dont la prolifération requiert des hydrates de carbone et des composés d'azote. Si la structure, la solubilité, le temps de transit jouent dans cette décomposition, l’essentiel provient d’enzymes bactériennes, les protéases, actives dans la partie distale du côlon où l’acidité est la plus forte. Les peptides par eux-mêmes ont un rôle important sur la biodiversité du microbiote colique. Outre la production d’acides gras correspondant à la fermentation des acides aminés, un des principaux corps produits par cette transformation est l’ammoniaque. Absorbée par la muqueuse colique, l’ammoniaque est transportée vers le foie où elle est transformée en urée, puis éliminée dans les urines. La production est cependant faible et sans effet notable sur la santé dans les régimes alimentaires équilibrés. Les lipides qui parviennent dans le côlon sont très divers. Le microbiote peut également les utiliser ou les transformer. Certaines bactéries agissent sur le cholestérol en le transformant en un corps qui ne peut être absorbé et qui est éliminé dans les selles, jouant ainsi un rôle dans la régulation de son métabolisme. Une part importante des sels biliaires produits à partir du cholestérol parviennent également jusqu’au côlon où ils sont métabolisés par les bactéries. Les bactéries du microbiote sont, de plus, une source importante de vitamines, parmi lesquelles les vitamines K, B12 mais aussi B1, B2, B6 et B9.
Les microbes commensaux ont une action majeure sur l'activation et la différenciation lymphoïdes
Ils induisent un faible niveau d’activation du système immunitaire par une inflammation physiologique autorisant leur tolérance, tandis qu’un pathogène conduit à une réaction d’une autre ampleur. Les microorganismes établissent une continuité entre ces deux extrêmes : commensaux et pathogènes se différencient par leur capacité à moduler la réponse immunitaire de l’hôte. Mieux encore, les bactéries résidentes éduquent le système immunitaire, l’entraînent à lutter contre les germes délétères. La plupart des connaissances sur ce sujet proviennent des études comparatives entre les animaux axéniques dépourvus de microbiote et leurs congénères élevés dans les conditions classiques des animaleries de laboratoire. Les rongeurs maintenus en milieu stérile présentent une raréfaction des structures lymphoïdes enchâssées dans la muqueuse de la partie terminale de l’intestin grêle, les plaques de Peyer. La réponse immunitaire intestinale mobilise ces formations de lymphocytes B et T. Leur développement anormal s’accompagne d’un déficit de l’épithélium digestif en lymphocytes. La rate et les ganglions lymphatiques disséminés dans tout le corps présentent également des anomalies architecturales et des zones lymphocytaires atrophiées, immatures. L’absence de stimulation par les commensaux est donc à l’origine d’une atrophie des organes lymphatiques secondaires qui dépasse la sphère digestive, affecte l’ensemble des zones lymphoïdes et perturbe l’homéostasie immunitaire de l’organisme dans sa globalité, notamment du fait d’une carence en lymphocytes matures. En plus de leur quantité, le microbiote préserve l’équilibre qualitatif des cellules de l’immunité. Certaines populations bactériennes favorisent la production de lymphocytes T dits Th17, qui ont un rôle important dans l’organisation de la réponse immune protectrice, tandis que d’autres bactéries stimulent les lymphocytes T régulateurs qui inhibent cette réponse. Les commensaux participent ainsi à l’équilibre entre tolérance et rejet, ils maintiennent le système immunitaire entre action et inhibition. Le microbiote n’a donc pas qu’une mission locale de maintien de l’équilibre entre les cellules immunes de l’intestin et les bactéries qui y prolifèrent. Il joue un rôle plus important pour l'homéostasie du système immunitaire.
Les menaces du microbiote
Le microbiote est lié à une série de pathologies dont il peut représenter, au moins indirectement, des facteurs favorisants et ainsi de nouvelles cibles thérapeutiques.
Le microbiote tient aujourd’hui une bonne place parmi les éléments qui favorisent la surcharge pondérale. Car la flore intestinale est particulière chez les sujets obèses. Elle y est globalement moins diversifiée, avec une augmentation des firmicutes et une diminution des bactéroïdes. Si on examine attentivement le spectre des gènes microbiens par étude métagénomique, l’analyse du microbiote des patients obèses révèle certaines spécificités. Il se caractérise par une prévalence élevée de cinq populations de bactéries qui ne varient pas qu’en nombre. Ces bactéries ont des fonctions particulières capables d'induire diverses manifestations délétères pour l’organisme. La moindre diversité génétique des souches est associée à une résistance à l’insuline, qui peut conduire au diabète, à une anomalie des lipides et à un syndrome inflammatoire que signent une série de biomarqueurs dosés dans le sang. D'autres éléments rattachent le microbiote à l'obésité. Ainsi le transfert de flore intestinale de souris obèses à leurs congénères non obèses induit une prise de poids importante chez les souris nouvellement colonisées.
Le microbiote semble jouer également un rôle dans les cancers coliques. On constate en effet une modification importante des populations de bactéries dans les selles des patients cancéreux : augmentation des anaérobies, notamment du groupe des bactéroïdes, avec production de toxines inflammatoires et, parallèlement, diminution du nombre des firmicutes. Ces modifications ne se retrouvent pas que dans les selles, elles existent aussi au contact de la tumeur, où les germes anaérobies prolifèrent. Elles s’accompagnent d’une diminution de la production de butyrate, métabolite d’importance qui représente le principal substrat énergétique de l’épithélium intestinal et, de plus, a un effet trophique sur le biofilm bactérien. En supprimant le premier biofilm de bactéries commensales et protectrices, on laisse la place à des microorganismes qui, insuffisamment contrôlés par la réponse immunitaire, suscitent une multiplication désordonnée des cellules intestinales jusqu'à les rendre cancéreuses. Ce mécanisme, à la fois simple et complexe, peut être résumé et reproduit dans des modèles de souris. Il suffit d’introduire une modification du biotope pour induire des cassures chromosomiques dans les cellules intestinales et passer d’un stade purement inflammatoire, une altération bénigne, à la genèse du cancer.
Il est depuis longtemps admis qu’il existe un axe cerveau–intestin. Le cerveau influence les capacités motrices, sensitives et sécrétoires dans l’intestin. Nous devons au cerveau le péristaltisme intestinal qui assure la progression des aliments, mais aussi du microbiote, par la motilité qu’il instille à travers 200 millions de neurones, soit mille fois moins que le cerveau lui-même, mais autant que le cortex d'un chien ou d'un chat. 95% de la sérotonine, un des médiateurs du système nerveux qui participe à la gestion de nos émotions, est sécrétée par l’intestin. Les sécrétions bactériennes peuvent influencer le cerveau en produisant des neurotransmetteurs. Le nerf vague transmet directement les informations des viscères à l’hypothalamus, structure profonde du cerveau essentielle dans les comportements émotionnels, et à l’amygdale, une zone cérébrale qui coordonne des activités végétatives et sensitives. Tous ces éléments donnent ainsi du poids à une série d’expériences qui, depuis quelques années, relient le microbiote au comportement. Ainsi, des souris qui naissent par césarienne et ne possèdent pas les microbes qui vivent normalement dans le vagin ou le rectum maternel, semblent plus anxieuses que leurs congénères nées par voie basse. De meilleures preuves viennent de la transplantation fécale croisée de rats ou de souris d'humeurs différentes. Deux souches de souris qui possèdent des habitudes comportementales distinctes peuvent échanger celles-ci par transplantation de leur microbiote. Des souris timides et anxieuses qui réagissent fortement au stress, deviennent de véritables exploratrices, et vice-versa. Le microbiote est également mis en cause chez des enfants présentant des douleurs abdominales périodiques, ou encore dans l’autisme.
Un certain nombre de travaux relient le microbiote à l’apparition de maladies allergiques, auto-immunes ou inflammatoires à partir d’une théorie, la théorie hygiéniste, qui stipule que l’excès d’hygiène et d’antibiotiques a favorisé leur essor. Cette hypothèse hygiéniste est née d’observations montrant que dans les familles nombreuses, rhumes des foins et eczémas frappaient plus souvent les aînés, moins exposés que leurs cadets aux infections et au défaut d’hygiène. Ceci suggérait que l’exposition en bas âge aux microbes était nécessaire à l’éducation du système immunitaire. Cette idée fut confortée par le fait que les enfants de milieux ruraux, en contact avec une grande variété de microbes, sont souvent moins à risque de devenir asthmatiques et allergiques. Or les quatre ou cinq dernières décennies ont été marquées, dans les pays qui ont adopté des normes exigeantes d’hygiène, par une diminution considérable des maladies infectieuses telles que l’hépatite, la tuberculose, la rougeole ou le rhumatisme streptococcique. Simultanément, on a assisté à une augmentation spectaculaire des affections de nature allergique ou dysimmunitaire, telles que les maladies inflammatoires du colon – parmi lesquelles la maladie de Crohn –, le diabète insulino-dépendant de type 1 ou la sclérose en plaques. La fréquence de ces maladies suit un gradient décroissant en partant des pays du Nord vers ceux du Sud.
Agir contre les effets délétères du microbiote
Probiotiques, prébiotiques, xénobiotiques (substances produites par les bactéries), transplantations fécales sont autant de moyens pour modifier notre microbiote et ainsi potentiellement agir sur ces menaces.
ll existe plusieurs types de probiotiques qui se distiguent et se concurrencent par leurs bienfaits sur la santé, et plus spécialement leurs performances intestinales. Identifiées par genres, espèces, capacités d'adhésion, les bactéries et levures des probiotiques correspondent à plusieurs catégories de microbes. Les bacilles lactiques groupent aujourd’hui plus de cinquante espèces de lactobacilles. De multiples résultats démontrent que les probiotiques peuvent gagner l’intestin, survivre et se développer, même à titre transitoire, et accroître ainsi la diversité du microbiote. Mais il faut admettre que leur impact sur la santé est encore faible si on le compare à celui de l’alimentation ou des antibiotiques. La part de l’environnement, de la nourriture ou de la diète sur l’effet observé reste difficile à quantifier. Une des questions essentielles, celle qui résume toutes les autres, est de savoir déterminer si les probiotiques ont un impact sur la santé de l’homme et pas seulement sur l’écologie du microbiote. Cette preuve n’a pas encore été apportée, particulièrement au regard de la longue liste des maladies qu’une dysbiose du microbiote est supposée entraîner.
Les prébiotiques réduisent le nombre de pathogènes, une qualité attestée par l’incidence diminuée des diarrhées infectieuses et la moindre utilisation des antibiotiques. Il reste à en comprendre le mécanisme, qu’il s’agisse d’une redistribution de la colonisation des pathogènes par modification du biofilm, ou d’une stimulation des réponses innées et adaptatives du système immunitaire par les bactéries commensales.
Les xénobiotiques agissent sur la diversité de notre microbiote par l’action directe des antibiotiques sur la flore microbienne, qu’ils modifient ou détruisent selon les cas. Ici encore, la métagénomique permet d'appréhender ces effets, comme cela a été étudié pour certains antibiotiques de la famille des fluoroquinolones. On observe, trois à quatre jours après la prise du médicament, un effet important et rapide sur le microbiote intestinal, avec perte de diversité bactérienne et redistribution des communautés microbiennes. Qu’ils soient à large spectre ou non, les antibiotiques déséquilibrent notre flore, et à travers ce phénomène, ont un impact indirect sur de nombreuses maladies, notamment sur l'obésité. A cet égard, la perturbation de la flore intestinale par des antibiotiques pris dans les premières semaines de la vie est très certainement à éviter.
Les premières publications de l’utilisation de la transplantation fécale chez l’homme datent de 1958. Si ce traitement fécal a pour principale indication l’infection bactérienne à Clostridium difficile, les relations de plus en plus évidentes entre les anomalies du microbiote, la perte de sa biodiversité, le déséquilibre de ses fonctions et nombre de pathologies plaident en faveur de son utilisation dans d’autres maladies. L’avenir dira si le syndrome du colon irritable, les maladies inflammatoires de l’intestin, les allergies, l’obésité, l’autisme ou l’anorexie mentale, tout autant que le diabète de type 1 ou d’autres affections auto-immunes pourront bénéficier de cette modalité d’utilisation du microbiote humain, qui viendra alors s’ajouter à la panoplie des thérapeutiques déjà existantes.
Conclusions
L’étude du microbiote ouvre un nouveau paradigme en microbiologie, qui devrait intéresser toutes les sciences de la médecine et de la biologie, favoriser une approche pluridisciplinaire et associer la recherche académique et industrielle à son étude et à ses relations avec de nombreuses pathologies dites non transmissibles. C’est là un nouveau défi pour la recherche médicale reliant l’étude de l’écologie microbienne à une nouvelle approche environnementale, celle du corps humain.
[2] Debré P. Les révolutions de la biologie et le comportement humain, 2020, Odile Jacob Ed.
Jeanne Brugère-Picoux
Professeur honoraire de pathologie médicale du bétail et des animaux de basse-cour (Ecole nationale vétérinaire d’Alfort), membre de l’Académie nationale de médecine, présidente honoraire de l’Académie vétérinaire de France

L’incroyable capacité des chauves-souris à servir de réservoirs de virus émergents sans en être affectées
Les chiroptères, plus communément appelés chauves-souris, seuls mammifères volants, constituent environ 20% de la diversité des mammifères et sont largement distribués dans le monde. Ils présentent une longévité de plusieurs dizaines d’années, inhabituelle pour des animaux de petite taille au métabolisme élevé. Depuis peu de décennies, on a pu découvrir que ces chauves-souris pouvaient héberger de nombreux virus dont certains ont été à l’origine de maladies émergentes chez l’Homme ou l’animal. Ces réservoirs naturels de virus présentent aussi la particularité de ne pas être affectés par les agents infectieux qu’ils hébergent. On a pu montrer que les chauves-souris étaient résistantes à des doses mortelles pour d'autres mammifères d’hénipavirus et de lyssavirus. Cependant on connaît mal les mécanismes responsables de la capacité des chauves-souris à coexister avec les virus. Leur adaptation au vol favoriserait une élévation de leur température corporelle permettant d’accroître l’efficacité de la réponse immunitaire. Cette coexistence entre virus et chauves-souris serait aussi liée à une réponse atténuée en interférons.
Lors de l’émergence d’une maladie virale impliquant des chauves-souris, le franchissement occasionnel de la barrière d’espèce de la chauve-souris à l’Homme ou l’animal fut souvent lié à une modification des écosystèmes largement liée à des activités humaines ayant permis de mettre en relation des espèces animales sauvages (chauve-souris ou hôtes intermédiaires) avec l’Homme ou certaines espèces animales domestiques alors qu’il n’existait que peu de contacts auparavant. C’est ainsi que les chauve-souris ont été les pourvoyeuses de maladies zoonotiques émergentes redoutables dont :
- les lyssavirus de la rage, dont les réservoirs animaux sont actuellement les chauves-souris et les carnivores, les chauves-souris constituant probablement le réservoir originel des lyssavirus ;
- les henipavirus : le virus Hendra, rencontré en Australie depuis 1994, responsable d’une affection heureusement rare car souvent mortelle de l’Homme et du cheval ; le virus Nipah, identifié en 1998 lors d’une épidémie affectant des fermes porcines présentant des troubles respiratoires en Malaisie mais aussi les personnes en contact avec les porcs (265 malades, dont 105 décès à la suite d’une encéphalite). C’est un peu plus tard que l’on découvrit que des chauve-souris frugivores (Pteropus sp.) étaient à l’origine de cette épidémie qui s’est étendue au Bangladesh en en Inde, notamment par la consommation de jus de palme contaminé.
- les filovirus : le virus de Marburg, décrit tout d’abord en Allemagne en 1967 à la suite de contaminations dans un laboratoire travaillant sur des cellules rénales de singes verts, puis découvert chez les chauves-souris et à l’origine de contaminations mortelles au Kenya à la suite de visites de grottes hébergeant des chauves-souris en 1980 ; le virus Ebola où le rôle réservoir de la chauve-souris fut démontré en 2005.
- certains coronavirus et plus spécifiquement des betacoronavirus, comme le virus du syndrome respiratoire aigu sévère (Sras) et celui du syndrome respiratoire du Moyen-Orient (Mers), puis celui de la Coronavirus disease 2019 ou Covid-19.
Origine des coronavirus
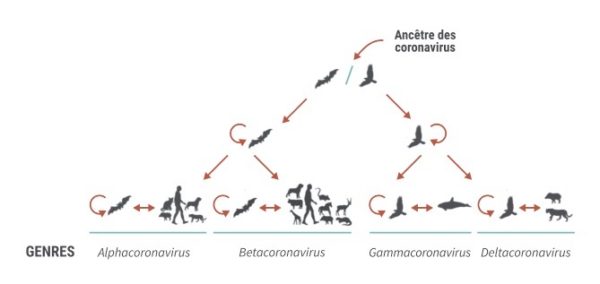
Les coronavirus sont des virus à ARN classés en Alphacoronavirus, Betacoronavirus, Gammacoronavirus et Deltacoronavirus. Leur nom vient de leur conformation, avec l’observation de spicules formant une sorte de couronne.
Les coronavirus semblent provenir des chauves-souris, et plus particulièrement les Alphacoronavirus et les Betacoronavirus (genre où l’on observe des zoonoses), ce qui explique le grand nombre de virus isolés dans ces espèces alors que les oiseaux seraient à l’origine des Gammacoronavirus et des Deltacoronavirus (fig. 1).
Le premier coronavirus identifié fut celui de la bronchite infectieuse aviaire, en 1931 aux Etats-Unis, alors que les premiers coronavirus n'ont été décrits chez l’Homme que dans les années soixante. Il s’agissait alors d’un rhume souvent banal. Depuis, de nombreux virus ont été isolés chez les mammifères et les oiseaux.
La plupart des Alphacoronavirus sont spécifiques d’espèce. Ils peuvent être responsables de maladies graves comme le coronavirus du chat, responsable de la péritonite infectieuse féline, ou la gastroentérite transmissible (GET) du porcelet. L’émergence, en 1984, du coronavirus respiratoire porcin semble avoir pour origine une modification du virus de la GET.
La GET est devenue plus rare, parallèlement à l’émergence d’un autre coronavirus (Swine acute diarrhea syndrome coronavirus ou Sads-CoV), responsable de la diarrhée épidémique porcine (DEP), surtout importante dans le Sud-Est asiatique depuis 2010. En 2017, une importante épidémie chez les porcelets permit de démontrer que le réservoir animal de cette DEP était vraisemblablement la chauve-souris.
Classification des principaux coronavirus rencontrés chez l’Homme et les animaux
Alphacoronavirus
Différents coronavirus humains
Virus de la gastroentérite transmissible du porcelet
Coronavirus entérique du chien
Virus de la péritonite infectieuse féline
Virus de la diarrhée épidémique porcine
Coronavirus respiratoire porcin (Sads-CoV)
Différents coronavirus de la chauve-souris
Betacoronavirus
Coronavirus du Sras (Sars-CoV)
Coronavirus du Mers (Mers-CoV)
Coronavirus de la Covid-19 (Sars-CoV2)
Virus de la sialodacryoadénite du rat
Virus hémagglutinant de l’encéphalomyélite porcine
Coronavirus bovin
Virus de l’hépatite de la souris
Différents coronavirus de la chauve-souris, dont le virus Bat-CoV RaTG13
Gammacoronavirus
Virus de la bronchite infectieuse aviaire
Virus de l’entérite transmissible de la dinde
Coronavirus du Beluga
Deltacoronavirus
Différents coronavirus aviaires
Le Sras fut responsable d’une épidémie sévère, de février à mai 2003, avec un taux de mortalité de 10%, tuant 774 personnes sur 8096 malades, surtout en Chine mais le Canada fut aussi très touché (avec 43 décès sur 251 malades). Il a fallu mettre en place d’importantes mesures de biosécurité pour assister à la fin de l’épidémie. Quand le Sras est arrivé à la mi-novembre 2002 dans la province du Guangdong, les cas n’ont pas été officiellement notifiés par crainte d’éventuelles retombées sociales ou économiques, permettant ainsi une large diffusion du virus. L’organisation mondiale de la santé (OMS) n’a été prévenue que le 11 février 2003...
Le Mers est apparu plus tard, en septembre 2012, et concerne principalement le Moyen-Orient, l’animal réservoir étant le dromadaire. A la fin de novembre 2019, 2494 cas ont été confirmés, dont 858 décès (soit un taux de mortalité de 34,4%). L’Arabie Saoudite a été le pays le plus touché avec 2102 cas, dont 780 décès (soit un taux de mortalité de 37,1%).
Alors que les premiers cas de Sras ont été observés en 2002 dans la province du Guangdong, il s’avère que la source géographique du virus semble être la province de Yunnan, ou le sud-ouest de la Chine, le principal réservoir animal étant vraisemblablement des chauves-souris fer à cheval (Rhinolophus sinicus). Une surveillance réalisée sur plus de cinq années sur ces chauves-souris dans une grotte de la province de Yunnan a permis de démontrer l’importante quantité de coronavirus pouvant être hébergés par ces chiroptères, dont certains proches du virus du Sras (Sars-CoV) et dénommés Sars-related coronavirus (Sarsr-CoV). Les scientifiques chinois soulignèrent même en 2017 que ces nouvelles informations sur l'origine et l'évolution du Sars-CoV mettaient en évidence la nécessité de se préparer à l'émergence future de maladies comme le Sras...
D’autres scientifiques américains avaient signalé dès 2015 le potentiel d’émergence des coronavirus présents dans les populations de chauves-souris, en particulier le coronavirus Shco14-CoV circulant couramment chez les chauves-souris fer à cheval du fait de sa réplication identique au Sars-CoV dans des cellules primaires de poumon humain. Ces mêmes scientifiques concluaient : « On ne sait pas si certains de ces coronavirus seront à l’origine d’un nouvelle épidémie mais il faut prévoir quand et comment s’y préparer pour y faire face »... Il était surtout évident pour ces scientifiques que la Chine représentait la zone à haut risque (le point chaud) d’où partirait l’épidémie.
La prédiction de ces scientifiques américains et chinois s’est réalisée avec l’apparition en décembre 2019 d’une pneumonie d’origine inconnue touchant 59 personnes dans la ville chinoise de Wuhan. Les personnes atteintes avaient surtout fréquenté le marché de fruits de mer de la ville où l’on vendait plusieurs animaux domestiques et sauvages, souvent vivants. Le 2 janvier 2020, ce marché fut fermé sans que l’on ait recherché l’origine de la contamination parmi les espèces animales vendues. Cette maladie émergente (dénommée Coronavirus disease 2019 ou Covid-19) est due à un coronavirus (Sars-CoV-2) où une autre chauve-souris fer à cheval (Rhinolophus affinis) est de nouveau incriminée en tant que réservoir. L’étude du génome du Sars-CoV-2 confirme qu’il s’agit d’un virus proche à 96,2% d’un coronavirus présent chez la chauve-souris (Sarsr-CoV;RaTG13), ce virus étant plus éloigné du virus du Sras (79%) ou de celui du Mers (50%).
Origine de la contamination par les coronavirus du Sras et de la Covid-19
On ne connaît pas l’origine exacte de la contamination humaine par le Sars-CoV-2 alors que l’on connaît le lien épidémiologique avec un marché aux animaux vivants sauvages ou domestiques, qui n’est pas sans rappeler l’origine du Sras également liée à un marché d’animaux vivants en Chine. La question n’est actuellement pas résolue et l’on ne peut que se baser sur les études réalisées sur le Sras-CoV. On peut regretter que des prélèvements n’aient pas été réalisés sur les animaux (en particulier les animaux sauvages) vendus vivants dans une grande proximité sur le marché de Wuhan malgré l’illégalité de leur vente avant la fermeture de ce marché.
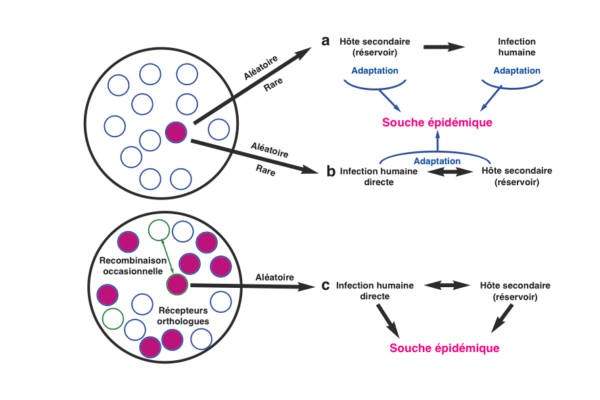
On peut retenir trois hypothèses à l’origine du franchissement d’un coronavirus de la barrière d’espèce de la chauve-souris vers l’Homme (fig. 2) :
a) Virus mutant avec nécessité d’un hôte intermédiaire pour infecter l’Homme
Si l’on se rappelle l’épidémie du Sras, des civettes palmistes masquées (Paguma larvata) d’origine sauvage ou provenant de fermes d’élevage, vendues vivantes sur les marchés, furent rapidement incriminées en tant que réservoirs de l’agent pathogène du coronavirus et il s’ensuivit un abattage massif de ces petits Viverridae par mesure de précaution avant que l’on ne découvre que la chauve-souris était le réservoir principal du Sars-CoV. Il s’ensuivit que l’hypothèse que la civette avait été l’hôte intermédiaire contaminée par la chauve-souris puis ayant contaminé ultérieurement l’Homme.
D’autres espèces présentes sur les marchés d’animaux vivants se sont révélées porteuses du Sars-CoV sans être retenues en tant qu’hôtes intermédiaires à l’origine du Sras : le chien viverrin (Nyctereutes procyonoides), surtout recherché pour sa fourrure, et le blaireau furet (Melogale moschata) ainsi que les renards roux, les chats domestiques et les rats, ces espèces ayant pu avoir été contaminées par les civettes palmistes masquées, voire l’Homme sur les marchés (ou inversement).
Rappelons que d’autres animaux ont pu être infectés expérimentalement par le Sras-CoV : singes, chats et furets, souris, cobayes, hamsters.
Dans le cas de la Covid-19, le seul animal actuellement suspecté en tant qu’hôte intermédiaire potentiel entre la chauve-souris et l’Homme est le Pangolin (Manis pentadactyla et Manis javanica en Asie) mais les analyses métagénomiques permettant une telle suspicion nécessitent d’être confirmées. Le pangolin, de l’ordre des Pholidotes, vit dans les forêts en se nourrissant de termites et de fourmis. Cet animal sauvage est apprécié en Asie pour sa viande mais aussi pour ses écailles qui auraient des propriétés thérapeutiques en médecine traditionnelle asiatique. Il s’agit d’une espèce très braconnée dans le monde alors que la Convention internationale sur le commerce d'espèces sauvages menacées d'extinction (Cites) a voté en 2017 l’interdiction totale du commerce international des pangolins. L’avantage de la suspicion concernant le pangolin dans la Covid-19 sera un contrôle plus strict de son commerce, permettant de le protéger.
La possibilité d’un éventuel portage du Sars-CoV-2 par les animaux de compagnie a été évoquée lorsque l’on a découvert à Hong Kong, fin février 2020, un chien positif dont la propriétaire était malade. Le suivi de ce chien a permis de noter à plusieurs reprises un très faible taux de virus dans les premières voies respiratoires puis des résultats négatifs et l’absence d’anticorps sériques témoignant d’une infection transitoire et permettant de penser que la contamination s’est effectuée de la propriétaire vers le chien. Le chien est décédé deux jours après son retour de quarantaine chez sa propriétaire mais celle-ci a refusé une autopsie pour connaître la cause de ce décès. Il est vraisemblable que la mort du chien, de race Spitz nain (poméranien), très âgé (17 ans), a été causée par le stress de la quarantaine loin de sa propriétaire.
Un second chien de compagnie, de race berger allemand, dont le propriétaire était contaminé a été également découvert positif à plusieurs reprises et est en quarantaine à Hong Kong au 19 mars 2020. Comme le chien précédent, il ne présente aucun signe clinique. Un chien de la même résidence est aussi en quarantaine et sous surveillance bien que négatif. Le virus semble donc bien se transmettre aux chiens. Néanmoins, rien n’indique pour le moment que les chiens peuvent le transmettre à leur tour aux personnes non infectées ou à d’autres animaux rencontrés par exemple dans la rue. Il n’avait d’ailleurs jamais été observé que le Sars-CoV avait été transmis d’un animal de compagnie (chien ou chat) vers l’Homme mais il est justifié de respecter les mesures de biosécurité préconisées pour la Covid-19 en tenant compte aussi d’un portage viral possible par des animaux de compagnie lorsque leur propriétaire est contaminé.
b) Virus mutant infectant directement l’Homme
Mais le rôle d’hôte intermédiaire de la civette palmiste masquée reste hypothétique : si plusieurs cas de contamination humaine semblent avérés à partir de civettes palmistes masquées, dont certains cas bénins de Sras réapparus en 2004, il s’avère que des civettes palmistes masquées d’origine sauvage pouvaient être négatives, comme d’autres civettes dans des fermes d’élevage. Certaines civettes ont pu être contaminées dans les marchés d’animaux vivants ou dans les élevages souvent en surdensité animale, avec un mélange de diverses espèces animales.
Il s’agirait alors de la deuxième hypothèse, à savoir une contamination directe de l’Homme à partir de la chauve-souris, les civettes masquées ayant joué un rôle réservoir secondaire favorisant le maintien de l’infection animale et humaine dans les marchés d’animaux vivants. Cette hypothèse est plausible car une analyse phylogénétique a montré que les premières souches humaines du Sars-Cov étaient plus étroitement liées aux souches chauves-souris qu'aux souches civettes.
En Chine, les animaux sauvages et domestiques sont souvent vendus vivants sur les marchés (parfois abattus au moment de la vente). La promiscuité de ces différentes espèces peut favoriser des transferts inter-espèces et parfois une contamination à l’Homme. Cela a été démontré pour une autre maladie virale rencontrée en Chine : les cas humains dus au virus aviaire influenza H7N9 observés ont pu diminuer drastiquement en 2013 avec l’interdiction des marchés de volailles vivantes à l’origine des contaminations.
c) Adaptation ou recombinaison du virus permettant d’infecter directement l’Homme
La troisième hypothèse permet de suspecter une contamination directe de l’Homme à partir de la chauve-souris à la suite d’une recombinaison d’un Sarsr-CoV présent chez l’animal. La recombinaison pourrait avoir lieu au niveau de la protéine S (dénommée spike du fait de sa forme en pointe).
La plupart des chauves-souris hébergeant les Sarsr-CoV se retrouvent en Chine, surtout dans certaines zones rurales du sud de la Chine (province de Yunnan) où les habitations sont proches de grottes abritant des Chiroptères. Une étude sérologique montrant 2,7% de séropositivité chez 218 personnes vivant à proximité de ces grottes permet de suggérer la possibilité d’une contamination directe.
Les chauves-souris, consommées régulièrement, peuvent être vendues vivantes sur des marchés, favorisant ainsi les franchissements des barrières d’espèce, notamment vers l’Homme. Le risque est surtout plus élevé pour le chasseur manipulant les animaux, avec la possibilité de contact avec le sang ou la survenue de morsures, que pour l’acheteur. Les contacts fréquents entre l’Homme et des chauves-souris vivantes peuvent être aussi la conséquence d’un changement dans leurs écosystèmes naturels (changement climatique, déforestation, urbanisation...).
Une contamination par des animaux vendus sur le marché de Wuhan ayant été fortement suspectée dès le début de l’épidémie, ce marché a été fermé rapidement sans que des prélèvements aient été effectués sur les animaux vivants vendus alors que l’on connaissait le rôle important joué par ces marchés dans l’épidémie du Sras.
Comme tous les virus à ARN de manière générale, les coronavirus sont connus pour avoir un taux de mutation élevé pendant la réplication et sont sujets à la recombinaison si différents virus infectent le même individu. Les populations de chauves-souris hébergent plusieurs types de coronavirus (cercles blancs à contour bleu). Le Sars-CoV serait la conséquence d’une mutation au sein de l’hôte (cercle rouge) ayant permis de façon aléatoire et rare l’émergence d’une souche chez un nouvel hôte.
La première hypothèse (a) concerne un hôte intermédiaire comme la civette (souche civette) ayant permis ultérieurement la contamination humaine. Cependant les premières souches humaines du Sars-CoV étant plus étroitement liées aux souches chauves-souris qu'aux souches civettes, il est possible que la contamination humaine ait été directe à partir de la chauve-souris (hypothèse b), les civettes masquées ayant joué un rôle réservoir secondaire favorisant le maintien de l’infection animale et humaine dans les marchés d’animaux vivants. Une troisième hypothèse (c) est la présence de multiples virus proches du Sras n’ayant pas subi de mutation et hébergés par les chauves-souris. Une adaptation secondaire ou une recombinaison avec une protéine de pointe lui permettant de se lier aux récepteurs cellulaires humains (cercle de contour vert) peut favoriser une contamination directe de l’Homme.
Aspects cliniques et épidémiologiques de la Covid-19
Au début de l’apparition de la maladie en Chine, les symptômes observés, rappelant ceux d’une affection grippale avec de la toux et une hyperthermie, n’étaient pas identiques au Sras et les premiers cas de mortalité rapportés concernaient des personnes âgées et/ou atteintes d’autres affections sévères. Cela peut expliquer les premiers propos rassurants de l’OMS alors que les autorités chinoises mettaient en place des mesures de biosécurité particulièrement exceptionnelles (56 millions de personnes confinées dans la province de Hubei, interdiction du commerce d’animaux sauvages, interdiction de voyager, fermeture de la Cité interdite, de la Grande Muraille et des parcs Disney, importantes restrictions de circulation, construction d’hôpitaux dédiés en quelques jours, prolongement du congé du nouvel an chinois, etc.). Ce n’est que le 11 mars 2020 que l’OMS a déclaré qu’il s’agissait d’une pandémie (il s’agit de la première pandémie causée par un coronavirus).
Cependant le virus a pu se propager pendant plus de deux mois en Chine, voire dans d’autres pays, avant la mise en place des mesures de biosécurité drastiques décidées après le 23 janvier 2020, de nombreux déplacements de personnes ayant pu avoir lieu, en particulier avec les préparatifs du nouvel an chinois.
Le 20 mars 2020, la pandémie de Covid-19 a surtout concerné la Chine (81 250 infectés, dont 3253 décès) sur les 246 275 déclarés, l’Italie étant le second pays le plus touché (41 035 infectés et 3405 décès). La France est le septième pays touché (10 891 cas, dont 371 décès). Alors que le taux des nouveaux cas quotidiens diminue en Chine (le berceau de cette pandémie), les autres pays voient la maladie se propager, souvent de façon exponentielle car il n’y a pas eu un contrôle des voyageurs arrivant de Chine lors du début de l’épidémie, ce contrôle étant d’ailleurs particulièrement difficile du fait de cas asymptomatiques. Il est difficile de connaître maintenant le nombre exact de personnes réellement infectées car le virus circule maintenant dans le monde entier sans que des tests soient maintenant effectués sur toutes les personnes atteintes, en particulier chez les personnes présentant des symptômes discrets, d’autant plus qu’il est possible que certaines personnes infectées comme les jeunes enfants puissent être asymptomatiques.
Une étude chinoise sur 44 672 cas confirmés de Covid-19 (dont 1716 soignants) a permis de noter un taux de mortalité moyen de 2,3%, ce taux augmentant avec l’âge (8% entre 70 et 79 ans, 14,8% au-delà de 80 ans).
Selon une étude chinoise récente, qui reste à confirmer, portant sur 103 virus Sras-Cov-2, il existerait deux souches circulantes, L et S. La souche S (30% des échantillons) serait plus ancienne que la souche L (70% des échantillons), cette dernière pouvant être plus agressive et se propager rapidement.
Conclusion
Il y aura toujours des maladies émergentes. Une étude effectuée sur 335 maladies ayant émergé entre 1940 et 2008 a permis de noter que 60% d’entre elles étaient des zoonoses – c’est-à-dire pouvant infecter l’Homme et l’animal –, dont 72% dues à la faune sauvage. C’est pourquoi le concept «une seule santé» est mis en avant par de nombreuses organisations internationales reconnaissant les liens entre la santé humaine, la santé animale et l’environnement.
Lors d’une zoonose émergente, il importe aussi de connaître rapidement l'espèce animale qui en est à l’origine, ainsi que les autres espèces pouvant jouer le rôle de réservoirs potentiels ou d’hôtes intermédiaire, en collectant le plus rapidement possible des prélèvements appropriés, avant de pouvoir mettre en place rapidement des mesures efficaces de biosécurité.
La mise en évidence chez les Chiroptères de coronavirus pouvant provoquer deux épidémies comme le Sras à partir de 2002 puis le Covid-19 en 2019 doit nous amener à reconsidérer nos stratégies de prévention de ces endémies en évitant le risque de contamination par une cohabitation trop étroite avec les chauves-souris par modification de leur écosystème et leur consommation.
Il faut aussi éviter les possibilités de transfert de certains virus émergents vers l’Homme par le mélange de plusieurs espèces d’animaux sauvages ou domestiques vendus vivants ou non sur les marchés asiatiques, véritables chaudrons réservoirs de virus et centres d'amplification pour les infections émergentes. Il faut espérer que l’interdiction des marchés d’animaux vivants, et plus particulièrement d’animaux sauvages, sera maintenue avec rigueur en Chine. Cela impliquera une importante modification des habitudes alimentaires dans plusieurs régions chinoises.
Enfin, les répercussions médicales, économiques et médiatiques de la pandémie due à la Covid-19 démontrent l’importance à accorder à l’étude des coronavirus chez les Chiroptères, mais aussi à protéger ces espèces dont certaines sont insectivores et fort utiles dans la lutte contre les moustiques. L’important est de maintenir un écosystème favorable à tous, animaux sauvages ou domestiques et l’Homme.
- Fan Y et al. Bat Coronaviruses in China. Viruses, 2019 Mar 2;11(3):210. doi: 10.3390/v11030210. PMID: 30832341; PMCID: PMC6466186.
- Hu B et al. Discovery of a rich pool of bat SARS-related coronaviruses provides new insights into the origin of SARS coronavirus. PLoS Pathogen, 2017, 13.
- Menachery VD et al. A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence. Nature Medicine, 2015, 21:1508-1513.
- Rodhain F. Chauves-souris et virus : des relations complexes. Bull Soc Pathol Exot, 2015, 108:272-289 DOI 10.1007/s13149-015-0448-z.
- Woo PCY et al. Discovery of seven novel mammalian and avian coronaviruses in the genus Deltacoronavirus supports bat coronaviruses as the gene source of Alphacoronavirus and Betacoronavirus and avian coronaviruses as the gene source of Gammacoronavirus and Deltacoronavirus. J Virology, 2012, 3995-4008, doi :10.1128/JVI.06540-11.
- Zhengli Shi Z, Hu Z. A review of studies on animal reservoirs of the SARS coronavirus. Virus Research, 2008, 133:74-87.
Francis Martin
Laboratoire d’excellence ARBRE, UMR Interactions Arbres/Micro-organismes, Centre INRAE Grand Est-Nancy

Les arbres forestiers remplissent leurs fonctions d’absorption de l’eau et des éléments minéraux du sol grâce à une interaction symbiotique mutualiste entre leurs racines et une grande diversité de champignons. La sylviculture et la trufficulture mettent déjà ces connaissances en pratique, et les progrès de la recherche en biologie et en écologie dans ce domaine des interactions plantes/micro-organismes ouvrent de nouvelles perspectives d’application à la gestion durable et à la protection des forêts face aux changements climatiques.
Malgré les menaces multiples qui pèsent sur la plupart des environnements naturels, bois, forêts et prairies hébergent encore une richesse mycologique insoupçonnée. Des milliers d’espèces de champignons peuplent les forêts. A l’automne, cèpes, chanterelles, rosés des prés, coprins et lactaires sont récoltés en abondance et les fricassées de ces produits de la terre agrémentent de nombreuses tables familiales. Dans le langage populaire, ce qu'on désigne couramment comme «champignon» et que l’on cueille en forêt et dans les prairies n'est en fait que l’appareil reproducteur, une fructification temporaire et visible appelée le sporophore («qui porte les spores») par les mycologues. Le plus souvent composé d’un pied et d’un chapeau protégeant lamelles ou tubes, il est la production d'un organisme souterrain à caractère plus durable et plus discret constitué d’un lacis de filaments ouateux formés d’hyphes, le mycélium végétatif. Ce dernier émerge d’une spore sous forme d’un tube germinatif et se ramifie rapidement dans le sol, la litière et dans pratiquement tous les organes des arbres vivants ou morts. Le mycélium constitue la partie principale du champignon et il peut former des colonies pouvant couvrir plusieurs dizaines de mètres carrés et représenter jusqu’à 99% du poids de l’organisme. En dehors des sporophores, les champignons peuvent aussi être observés sous forme de spores, de rhizomorphes (faisceaux de plusieurs filaments mycéliens agrégés en fibres), de mycorhizes avec les racines des arbres ou de structures d’infection chez de nombreuses plantes.
On reconnaît trois grands groupes de champignons correspondant à différents modes de nutrition, en particulier vis-à-vis de l’acquisition du carbone :
- les décomposeurs, ou saprotrophes, qui dégradent et consomment efficacement les polysaccharides et les protéines de la nécromasse végétale, microbienne et animale,
- les symbiotes, qui s’alimentent des sucres simples (glucose) provenant de leur plante-hôte, mais en ayant des effets bénéfiques pour leur partenaire. Leurs réseaux mycéliens souterrains explorent le sol et la litière à la recherche d'éléments minéraux qu'ils transportent et transfèrent à leur plante-hôte en échange des sucres importés,
- les parasites, ou pathogènes, qui infectent les plantes et les animaux et détournent à leur profit les sucres et les acides aminés solubles accumulés dans les tissus colonisés, entraînant l'affaiblissement et parfois la mort de leur(s) hôte(s).
Les champignons décomposeurs jouent un rôle crucial en assurant la productivité et la stabilité à long terme de tous les écosystèmes terrestres, dont les forêts. En effet, ils assurent la libération des éléments minéraux de la nécromasse (par exemple, les feuilles et le bois mort) et leur recyclage dans la biomasse, permettant ainsi le maintien de la fertilité et la pérennité de la production primaire, essentiellement assurée par les arbres. Les champignons appartenant aux deux autres catégories, souvent regroupées sous le terme de biotrophes, sont plus directement responsables à court ou moyen terme de l’état du peuplement puisqu’ils vivent en partie à l’intérieur des tissus des arbres et affectent positivement (symbiotes mutualistes) ou négativement (parasites) leur métabolisme, leur physiologie et leur croissance. Les champignons symbiotiques ectomycorhiziens représentent très souvent plus de 50% de la communauté fongique d’une forêt dans les régions tempérées ou boréales.
Les mycorhizes des arbres forestiers
Dans nos forêts caducifoliées ou de résineux, les racines des grandes essences sylvicoles (par exemple Pins, Epicéa, Chênes, Hêtre) portent généralement des ectomycorhizes qui peuvent être formées par plusieurs centaines d'espèces de champignons basidiomycètes (par exemple Amanites et Bolets) et ascomycètes (par exemple, les Truffes). Morphologiquement, on distingue une racine courte ectomycorhizée d’une racine courte non mycorhizée par la présence du manteau fongique externe recouvrant la racine mycorhizée (Fig. 1). Les filaments mycéliens de ce manteau se développent d’une part vers l’intérieur de la racine, en s’insinuant entre les cellules de l’épiderme et du parenchyme cortical racinaire pour former le réseau de Hartig et d’autre part, un réseau mycélien qui explore le sol. La croissance du réseau ramifié de filaments mycéliens externes peut être considérable (jusqu’à 1000 m de mycélium par mètre de racine), augmentant ainsi considérablement le volume de sol exploité par l’arbre mycorhizé. Le réseau mycélien qui explore ce volume de sol est capable de mobiliser des éléments minéraux (par exemple le phosphate inorganique) inaccessibles aux racines de la plante-hôte et de les transférer, sous leur forme initiale ou après les avoir transformés, à leur associé végétal. Outre les ressources minérales solubles (phosphate, azote minéral), les champignons ectomycorhiziens sont également capables d’altérer les minéraux et d’exploiter une partie des ressources accumulées dans la matière organique des sols en sécrétant des protéases, des phosphatases ou des polyphénols oxydases. On comprend facilement que l’établissement de ces associations symbiotiques ectomycorhiziennes apparaisse comme une stratégie importante pour assurer la survie et la croissance des arbres.
(A)

(B)
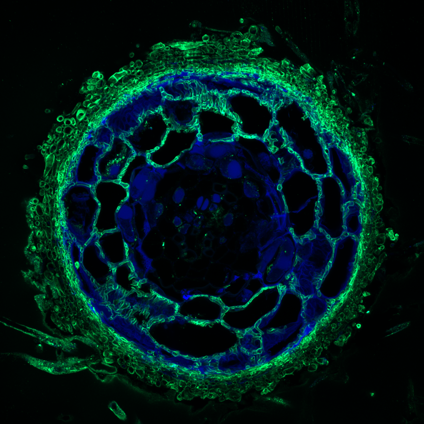
Mais comment le champignon symbiotique reconnaît-il son partenaire végétal ? Comment la plante-hôte distingue-t-elle le champignon bénéfique du champignon parasite ? Comment le champignon évite-t-il les défenses immunitaires de la plante ? Tout est question de dialogue biochimique et moléculaire ! Les racines de la plante apte à contracter la symbiose libèrent dans le milieu qui les entoure des quantités infinitésimales de molécules «signales». La perception de ces signaux chimiques déclenche la libération par le champignon de petites protéines dans les racines qu’il colonise. Celles-ci se lient au récepteur de l’acide jasmonique, l’hormone de défense de la plante, neutralisant ainsi les réactions défensives qu’aurait dû induire la présence massive du champignon dans la racine. Le champignon symbiotique contrôle ainsi la réponse immunitaire de la plante colonisée. Il peut alors s’établir et développer un troc avec la plante «sous influence» qui l’héberge.
Pendant plus d’un siècle, l’étude de la symbiose mycorhizienne a reposé sur l’idée simpliste d’une association bénéfique entre une plante et un champignon uniquement. Les recherches actuelles conduites sur le terrain révèlent cependant que ces associations mutualistes établissent des interactions multiples impliquant plusieurs partenaires. La symbiose mycorhizienne structure un véritable réseau de plantes et de champignons d’espèces différentes, reliés entre eux : jusqu’à plusieurs centaines d’espèces de champignons par arbre et une vingtaine d’arbres colonisés par un même champignon. Des plantes voisines, même d’espèces différentes, peuvent donc partager des champignons communs. L’étude des implications fonctionnelles et écologiques de ces réseaux tissés entre champignons et arbres débute et nécessite la mise en place d’expérimentations complexes sur le terrain.
Les réseaux mycorhiziens établissent des flux nutritifs entre plantes
Lors d’une expérience, menée dans les années quatre-vingt-dix par le professeur Suzanne Simard, de jeunes bouleaux et sapins de Douglas ectomycorhizés par le même champignon, ont été marqué par l’apport de CO2 enrichi en isotopes 13C et 14C. Ces marquages révélèrent que les arbres, connectés par les réseaux mycorhiziens souterrains, recevaient chacun du carbone, vraisemblablement des sucres solubles, l’un de l’autre, avec un flux net en faveur du sapin de Douglas. La quantité de sucres reçus par ce dernier représentait de 10 à 25% des produits de sa photosynthèse. Le réseau ectomycorhizien est donc bien impliqué dans les transferts entre bouleau et sapin de Douglas. Une expérience plus récente, réalisée dans une forêt du Jura suisse, a permis d’évaluer qu’environ 4% des composés carbonés issus de la photosynthèse d’un arbre sont transportés vers les arbres voisins connectés au même réseau ectomycorhizien. Ces mesures instantanées du flux de carbone ne permettent néanmoins pas de calculer l’impact global sur la plante durant toute la saison de végétation et sur son budget nutritionnel à long terme.
Le réseau mycorhizien permet l’échange d’autres ressources que les sucres entre plantes, comme le démontrent des dispositifs simples où on cultive deux plantes mycorhizées dans un même sol. On a ainsi pu démontrer des flux d’azote, de phosphate, ou encore d’eau par le réseau symbiotique.
La communication entre les partenaires symbiotiques
Terminons en mentionnant l’un des effets les plus surprenants du réseau mycorhizien sur les plantes qu’il connecte : la mise en place d’un dialogue impliquant des signaux d’alerte. Dans une plante infectée par un champignon parasite, ou grignotée par une chenille, des réactions de défense se mettent en place qui limitent l’attaque de l’agent infectieux et qui impliquent la production d’hormones de stress, comme l’éthylène ou le jasmonate de méthyle. Ces composés volatils déclenchent une cascade de réactions de défense aboutissant à l’accumulation de molécules toxiques pour l’intrus, par exemple de puissants inhibiteurs des enzymes digestives de l’insecte phytophage. Dans des expérimentations réalisées en chambre de culture, sous conditions contrôlées, des plantes proches reliées par un réseau mycorhizien souterrain, quant à elles vierges de toute attaque, mettent en place des défenses similaires quelques jours après l’attaque de leur voisine ! On ignore encore la nature des signaux (hormones, dépolarisations membranaires) et la façon dont ils transitent via les hyphes dans les conditions naturelles de la forêt, mais il n’y a pas de doute que les plantes dialoguent via leur réseaux mycéliens. Arbres et champignons forment ainsi d’immenses réseaux sociaux qui irriguent forêts, bois et prairies. L’activité de ces réseaux interconnectés est cruciale afin d’assurer le fonctionnement durable des écosystèmes, et leur maîtrise pourrait bien aider les forestiers à atténuer les effets désastreux du changement climatique.
Alain Delacroix
Professeur honoraire, chaire "Chimie industrielle - Génie des procédés" du Conservatoire national des arts et métiers
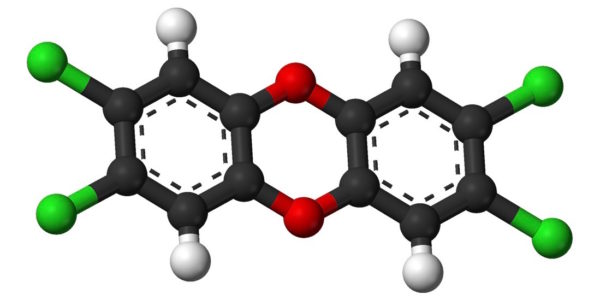
Nous sommes en juillet 1976 dans l’usine ICMESA de la société suisse Givaudan, qui fait partie du sérieux groupe Hoffman Laroche. On y fabrique du 2,4,5 trichlorophénol, matière première pour la synthèse d’herbicides et d’antiseptiques. Pour cela, on part du tétrachlorobenzène qui est hydrolysé par la soude entre 140 et 170 °C dans de l’éthylène glycol. Le réacteur de 10 m3 est chauffé par de la vapeur et l’on ne peut dépasser 180 °C. Il est possible de refroidir très vite en cas d’élévation de température et le réacteur possède un réfrigérant efficace. Pour éviter l’éventuelle explosion du réacteur, un disque de rupture est taré à 3,8 bars. Malheureusement, le refroidissement n’est pas automatisé.
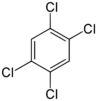
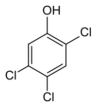
Le 9 juillet 1976, la réaction est démarrée mais on prend du retard et le samedi matin, le processus est stoppé avant la fin. L’agitation est arrêtée, le réacteur ramené à la pression atmosphérique, et les opérateurs partent en week-end. A 12h30, le disque de rupture éclate en raison d’une augmentation de température et en conséquence, de pression. Une partie de son contenu est éjecté par la cheminée de l’usine. A ce stade, il s’agit d’un incident banal.
Pourtant le lendemain, des enfants présentent des troubles et des petits animaux commencent à mourir. L’usine prévient alors les autorités qu’un nuage d’herbicide a été rejeté dans l’atmosphère. Plusieurs jours plus tard, des enfants présentent des brûlures de la peau et doivent être hospitalisés mais les médecins, qui ne connaissent pas la cause, ne peuvent les soigner.
Seulement dix jours plus tard, le groupe chimique informe de la présence de dioxine dans le nuage qui s’est échappé. En fait, dans le réacteur non agité, une réaction parasite exothermique s’est produite et a fait monter la température. Or on savait qu’au-dessus de 180 °C, le trichlorophénol réagit sur lui-même pour conduire à la 2,3,7,8 tétrachlorodibenzodioxine, dite maintenant dioxine de Seveso, et qui est la molécule la plus toxique de toutes ses congénères.
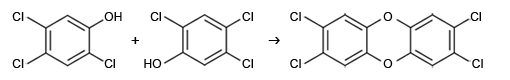
Après 14 jours, on décide d’évacuer certaines zones et on interdit la consommation des aliments produits dans la région atteinte. La population inquiète est révoltée car des personnes sont atteintes maintenant de chloracnée et de nombreux petits animaux sont morts. A cette époque, la toxicité de la dioxine est mal connue mais on en sait assez pour savoir qu’elle est dangereuse.
Le bilan est dramatique : deux mille hectares sont pollués, 3300 petits animaux sont morts et presque 80 000 sont abattus. Quelques avortements sont autorisés. Dans les trois zones les plus contaminées, 37 000 habitants ont été exposés. Le coût des indemnisations sera de 240 millions de dollars.
Heureusement, les effets à long terme sur la santé des personnes sont beaucoup moins importants que ce qu’on avait imaginé. Les études semblent contradictoires et on note dans certaines une augmentation du risque de cancers du sein et de cancers thyroïdiens. Curieusement, l’action œstrogène de la molécule a augmenté le nombre de naissance de filles : 48 filles sont nées pour 26 garçons dans la zone la plus contaminée. Une seule victime directement liée à l’accident est à déplorer : le directeur de production de l’usine a été assassiné par les Brigades rouges.
La décontamination va durer cinq ans. La terre, les animaux euthanasiés et les gravats sont placés dans des cuves étanches de 200 000 m3. La partie la plus contaminée de l’usine est placée dans 41 fûts en 1982 pour rejoindre l’usine CIBA de Bâle, dont l’incinérateur est apte à traiter la dioxine. Bizarrement, ceux-ci seront retrouvés en mai 1983 dans une entreprise désaffectée à Anguilcourt-le-Sart dans l’Aisne. Ils seront finalement incinérés en 1985. A la place de l’usine, il y a maintenant un complexe sportif et autour, on trouve une forêt constituant un parc naturel.
Au moment de l’accident de Seveso, on connaissait mal la toxicité de la dioxine et il se trouve que celle produite est la plus toxique. Elle est 10 000 fois plus toxique pour les êtres vivants que le cyanure de sodium mais 30 000 fois moins que la toxine botulique. Le hamster est beaucoup moins sensible que le cochon d’Inde d’un facteur de plusieurs milliers. Maintenant qu’on sait la détecter, on en trouve partout car des divers types de dioxines se forment dans toute combustion où sont présents du carbone et du chlore. Il s’en produit dans les volcans, dans les incendies, dans les anciens incinérateurs d’ordures ménagères, les barbecues... Solubles dans les graisses et très stables, ces molécules sont maintenant particulièrement surveillées dans les aliments.
L’accident de Seveso, au départ relativement banal, a conduit à une catastrophe écologique et financière qui a montré de graves manquements dans la sécurité du procédé chimique mais aussi dans celle de la gestion de la crise par les autorités. Cela a conduit aux directives Seveso conçues pour éviter les accidents chimiques mais aussi pour limiter leurs conséquences si par malheur ils surviennent.
Alain Foucault
Professeur émérite du Muséum national d'histoire naturelle (Paris)

Il y a 2 ans, nous avions signalé, sur ce même site Internet [1], combien était vive la course internationale aux supercalculateurs dont la puissance s’exprime en pétaflops, millions de milliards d'opérations par seconde. En tête de cette course, on ne s’étonnera pas de trouver les Etats-Unis et la Chine, les Etats-Unis avec Summit (148 pétaflops) et la Chine avec TaihuLight (93 pétaflops). La France ne peut égaler de telles performances mais ne fait pas mauvaise figure avec le nouveau calculateur Jean Zay, inauguré le 24 janvier 2020, et dont la puissance atteint 16 pétaflops. Ce calculateur a été installé pour GENCI, le Grand équipement national de calcul intensif, par HPE (Hewlett Packard Enterprise) à l’Institut du développement et des ressources en informatique scientifique (Idris) du CNRS, sur le plateau de Saclay près de Paris. Son accès est ouvert gratuitement à tout utilisateur académique souhaitant réaliser des travaux scientifiques relevant d’une mission de service public de recherche ou d’enseignement supérieur, ou à tout utilisateur industriel pour des travaux de recherche ouverte. Les résultats obtenus dans ce cadre doivent donner lieu à publication, à la fin de la période d'allocation.
Ce nouvel équipement est à mettre dans le contexte de la réalisation de l’ensemble scientifique, technologique et économique Paris Saclay inspiré par le succès de la Silicon Valley, projet mis en œuvre dans le cadre de la loi du 3 juin 2010 relative au Grand Paris.
Ce projet comporte essentiellement un volet scientifique, avec l'université Paris-Saclay (succédant à l’université Paris-Sud au 1er janvier 2020), ses 65 000 étudiants et ses 9000 enseignants et enseignants-chercheurs ainsi que, sur le campus, l’Institut polytechnique de Paris, regroupement de l’École polytechnique, l’ENSTA ParisTech, l’ENSAE ParisTech, Télécom ParisTech et Télécom SudParis.
Il comporte également un volet économique qui repose sur l'implantation des centres de recherche et développement des grandes entreprises et la création d'un écosystème favorable aux jeunes entreprises innovantes.
Il faut souligner l’effort particulier d’aménagement du territoire, centré sur la réalisation d'un grand campus urbain, moderne et attractif, mixant logement étudiant et résidentiel ainsi que lieux de vie, services et espaces publics.
Une simple traversée de ce campus suffit pour constater le dynamisme du projet par la vision des bâtiments déjà construits et de ceux qui sortent de terre dans un souci manifeste d’urbanisme et d’architecture.
Jeanne Brugère-Picoux
Professeur honoraire de pathologie médicale du bétail et des animaux de basse-cour (Ecole nationale vétérinaire d’Alfort), membre de l’Académie nationale de médecine, présidente honoraire de l’Académie vétérinaire de France

Le virus à l’origine de l’épidémie qui sévit actuellement en Chine est un betacoronavirus comme les virus du Sras et du Mers (syndrome respiratoire du Moyen-Orient). L’étude de son génome confirme qu’il ne s’agit ni du virus du Sras, ni de celui du Mers mais d’un virus proche à 96 % du coronavirus présent chez la chauve-souris. On ne connaît pas encore l’origine de la contamination humaine dans le marché de fruits de mer de Wuhan. Plusieurs hypothèses sont émises : serpents, rats des bambous, civette...
Les autorités de la ville chinoise de Wuhan ont annoncé, le 31 décembre dernier, l’apparition d’une pneumonie d’origine inconnue touchant 59 personnes, dont certaines avaient surtout fréquenté le marché de fruits de mer de la ville. Le marché fut immédiatement fermé, le 2 janvier, car plusieurs animaux domestiques et sauvages, souvent vivants, y étaient aussi vendus.
Cette contamination par des animaux sauvages était plus probable qu’une contamination par des fruits de mer si l’on se rappelle l’épidémie du syndrome respiratoire aigu sévère (Sras) ayant débuté en Chine en 2002 avant d’exploser en 2003, où des civettes sauvages vendues sur les marchés ont été incriminées en tant que porteurs du coronavirus.
Cependant, les symptômes observés, rappelant ceux d’une affection virale avec de la toux et une hyperthermie, n’étaient pas identiques au Sras et les premiers cas de mortalité rapportés concernaient des personnes âgées et/ou atteintes d’autres affections sévères.
Cela peut expliquer les propos rassurants de l’Organisation mondiale de la santé (OMS) même après que l’on ait identifié l’agent causal, un coronavirus dénommé «2019-nCoV».
L’OMS concluait, le 23 janvier, qu’il n’y avait pas d’urgence sanitaire au niveau mondial, contrairement aux propos plus alarmistes des autorités chinoises mettant en place des mesures particulièrement exceptionnelles (56 millions de personnes confinées dans la province de Hubei, interdiction du commerce d’animaux sauvages, interdiction de voyager, fermeture de la Cité interdite, de la Grande muraille et des parcs Disney, importantes restrictions de circulation, construction d’hôpitaux dédiés en quelques jours, prolongement du congé du nouvel an chinois, etc.).
Il faut noter qu’effectivement une pandémie ne semble pas d’actualité car il n’y a eu que quelques cas exportés de Chine pour le moment. Néanmoins, progressivement, l’OMS corrige son évaluation de la menace qui passe à «élevée» à l’international le 27 janvier puis «d’urgence de santé publique de portée internationale» le 30 janvier.
Un bétacoronavirus comme les virus du Sras et du Mers
Le 2019-nCoV est un betacoronavirus comme les virus du Sras et du Mers (syndrome respiratoire du Moyen-Orient).
Rappelons que le Sras, dont l’animal réservoir était une chauve-souris, a surtout provoqué une épidémie sévère de février à mai 2003, tuant 774 personnes sur 8096 malades, surtout en Chine mais le Canada fut aussi très touché avec 43 décès sur 251 malades [1].
Il a fallu mettre en place d’importantes mesures de biosécurité pour assister à la fin de l’épidémie. Quand le Sras est arrivé à la mi-novembre 2002 dans la province du Guangdong, les cas n’ont pas été officiellement notifiés par crainte d’éventuelles retombées sociales ou économiques, permettant ainsi une large diffusion du virus.
L’OMS n’a été prévenue que le 11 février 2003.
Le Mers, provoqué par un autre betacoronavirus, est apparu plus tard en septembre 2012 et concerne principalement le Moyen-Orient, l’animal réservoir étant le dromadaire.
A la fin de novembre 2019, 2494 cas ont été confirmés dont 858 décès (soit un taux de mortalité de 34,4%) [2]. L’Arabie saoudite a été le pays le plus touché avec 2102 cas dont 780 décès, soit un taux de mortalité de 37,1%.
L’étude du génome du 2019-nCoV publiée le 23 janvier par Peng Zhou [3] confirme qu’il ne s’agit ni du virus du Sras, ni de celui du Mers mais d’un virus proche à 96 % du coronavirus présent chez la chauve-souris (BATCoV RaTG13).
Le premier coronavirus identifié fut celui de la bronchite infectieuse aviaire en 1931 aux Etats-Unis alors que les premiers coronavirus ont été décrits chez l’Homme que dans les années soixante. Il s’agissait alors d’un rhume souvent banal. Depuis, de nombreux virus ont été isolés chez les mammifères et les oiseaux... Le mélange des espèces, notamment des porcs, des oiseaux et des animaux sauvages vendus sur des marchés favorise le transfert de certains virus à l’Homme comme, par exemple, le Sras.
Classification des coronavirus de l’Homme et des animaux (résumé des principaux coronavirus isolés)
Alphacoronavirus
Différents coronavirus humains
Virus de la gastroentérite transmissible du porcelet
Coronavirus du chien
Virus de la péritonite infectieuse féline
Virus de la diarrhée épidémique porcine
Différents coronavirus de la chauve-souris
Betacoronavirus
Coronavirus du Sras
Coronavirus du Mers
2019-nCoV
Virus de la sialodacroadénite du rat
Virus de hémagglutinant de l’encéphalomyélite porcine
Coronavirus bovin
Virus de l’hépatite de la souris
Différents coronavirus de la chauve-souris dont le virus BATCoV RaTG13
Gammacoronavirus
Virus de la bronchite infectieuse aviaire
Virus de l’entérite transmissible de la dinde
Coronavirus du Beluga
Deltacoronavirus
Différents coronavirus aviaires
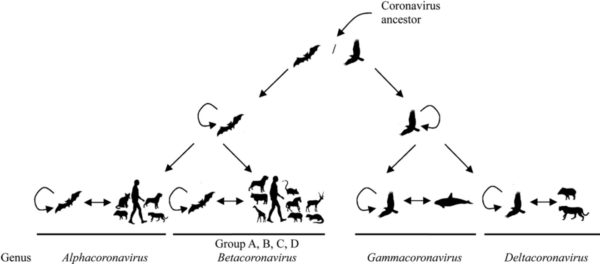
Plusieurs hypothèses de contamination
Cependant, on ne connaît pas encore l’origine de la contamination humaine dans le marché de fruits de mer de Wuhan. Plusieurs hypothèses ont été émises sans être formellement confirmées à la date du 26 janvier 2020 : serpents, rats des bambous, civette...
Ces animaux le plus souvent sauvages sont présentés vivants dans une grande proximité sur le marché, malgré l’illégalité de leur vente.
Lorsque les scientifiques chinois ont recherché en 2003 quels animaux sauvages vendus sur les marchés pouvaient être porteurs du virus du Sras, trois espèces se sont révélées positives : la civette masquée, le furet-blaireau et le chien viverrin [4].
Ces hôtes, qui ont pu être contaminés par les chauve-souris réservoirs primaires du virus, ont joué le rôle de réservoirs secondaires, permettant une contamination humaine.
Les répercussions médicales, économiques et médiatiques de l’épidémie chinoise due au 2019-nCoV pouvant être attribuée à des animaux sauvages vendus sur des marchés pour être consommés devraient amener les autorités chinoises à interdire plus sévèrement ce type de marché à l’avenir, une première leçon avec l’épidémie de Sras n’ayant pas été suffisante [5].
Au fur et à mesure que les jours passent, le scénario d’une maladie très sévère semble s’éloigner au détriment d’une plus forte contagiosité avec une augmentation progressive du nombre de cas.
Sous-déclaration des premiers cas
Les cas de pneumonie étaient observés depuis le 12 décembre 2019 à Wuhan et le virus a pu se propager pendant un mois et demi en Chine, voire dans d’autres pays avant la mise en place des mesures de biosécurité drastiques décidées après le 23 janvier 2020, de nombreux déplacements de personnes ayant pu avoir lieu, en particulier avec les préparatifs du nouvel an chinois.
Le maire de Wuhan a annoncé, le 26 janvier, que 5 millions des habitants de sa ville étaient partis avant le confinement, emportant potentiellement avec eux le virus aux quatre coins de la Chine et du monde.
Selon un épidémiologiste de Toronto [6], il y a eu une sous-déclaration des premiers cas car la moyenne d’âge des premières personnes confirmées (59 ans) est supérieure à la moyenne d’âge de la population chinoise (37-38 ans), les 17 premiers cas fatals touchant des personnes âgées (moyenne de 75 ans).
Il est alors possible que des formes bénignes touchant des personnes plus jeunes soient passées inaperçues alors que le virus pouvait être transmis par la voie aérienne.
Pour cette raison, il est difficile de préciser le pourcentage de mortalité lié au 2019-nCoV.
Ce virus semble plus contagieux que celui du Sras mais il est moins virulent. Le taux de mortalité, estimé à près de 2,6% avec 106 décès sur environ 4000 malades (au 28 janvier 2020), est inférieur à celui du Sras (10%) ou du Mers (37%) et il pourrait encore diminuer dans les jours à venir si l’hypothèse de cas bénins se confirme. Au 31 janvier, l’augmentation importante du nombre de cas (près de 10 000 cas), non proportionnelle à celle des décès (213), soit un taux de mortalité de 2,1%, confirme la forte contagiosité du virus et sa virulence plus modérée que celle du Sras mais plus importante que la grippe saisonnière (taux de mortalité : 0,32%).
L’étude des 41 premiers cas hospitalisés à l’hôpital de Wuhan a confirmé l’origine de la contamination (marché de fruits de mer).
Leur moyenne d’âge était de 49 ans et 13 d’entre eux avaient d’autres problèmes de santé (diabète : 8, hypertension : 6, et maladie cardiovasculaire : 6).
Les symptômes d’une grippe
Les symptômes sont ceux d’une grippe : hyperthermie, toux, myalgie ou fatigue. 26 malades présentaient une lymphopénie et tous présentaient des lésions de pneumonie.
Le taux de mortalité fut de 15% (6 malades décédés). Un foyer familial avec 6 cas de pneumonie (5 cas de pneumonie chez 6 personnes d’une même famille de Shenzhen ayant voyagé à Wuhan sans aller au marché de fruits de mer, mais deux d’entre eux avaient visité un hôpital, et un cas chez une autre personne de la famille n’ayant pas voyagé mais contaminée par la famille à son retour à Shenzhen) confirme le risque d’une propagation interhumaine du virus lors de déplacements [8].
Il est difficile de comparer l’évolution de cette épidémie en Chine avec celle du Sras du fait de l’importance des mesures de biosécurité exceptionnelles maintenant préconisées en Chine.
Les mesures de précaution prises maintenant par les médecins en Chine permettent d’éviter une contamination du personnel soignant (on notera toutefois qu’il y a eu 16 soignants contaminés parmi le personnel soignant, avec le décès d’un médecin).
Incubation de 14 jours
Du fait d’un temps d’incubation estimé jusqu’à 14 jours, on peut penser que le pic du nombre de cas pourrait se situer avant mi-février si les mesures de biosécurité ont été efficaces, en particulier dans la province de Hubei.
Cependant, la diffusion du virus en dehors de cet épicentre (on annonce un premier mort en dehors de l’épicentre, à Pékin le 28 janvier) est difficile à estimer et l’on ne peut pas prédire pour l’instant l’évolution de la maladie. Pour plusieurs épidémiologistes, l’épidémie pourrait durer plusieurs mois.
Au 30 janvier 2020, l’OMS dénombre 82 cas dans 18 pays. Il faut aussi espérer que tous les cas exportés de Chine contamineront peu de personnes autochtones, créant ainsi de nouveaux foyers. Parmi eux, seuls 7 ne se sont pas rendus en Chine. Une transmission interhumaine a été constatée dans 3 pays autres que la Chine (il faut y ajouter le 6e cas français correspondant à un médecin contaminé par une touriste chinoise). Un de ces cas est un cas grave ; il n’y a eu aucun décès.
En France, le risque semble pour le moment très limité avec six cas, dont cinq importés. D’autres cas sont possibles puisque des personnes arrivent toujours de Chine actuellement dans notre pays sans que l’on puisse réellement les contrôler et que l’on ne connaît pas l’importance de la répartition géographique actuelle du virus de Wuhan en Chine.
Cependant, on peut s’étonner de voir des personnes se précipitant pour acheter des masques qui seraient plutôt utiles pour éviter une contamination par le virus grippal (8000 à 14 000 décès par an en France, surtout chez les personnes fragiles).
[2] Données OMS novembre 2019.
[3] http://dx.doi.org/10.1101/2020.01.22.914952.
[4] Y et al. Isolation and characterization of viruses related to the SARS coronavirus from animals in Southern China. Science. 2003, 302:276–278.
[5] Cette interdiction formelle des marchés d’animaux sauvages vivants a été décrétée le dimanche 26 janvier par le autorités chinoises.
[6] D Fishman, PRO/AH/EDR> Novel coronavirus (19): China (HU) Transmission dynamics, promed@promedmail.org du 27 janvier 2020.
[7] Chaolin Huang et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. www.thelancet.com Published online January 24, 2020 https://doi.org/10.1016/S0140-6736(20)30183-5.
[8] Jasper Fuk-Woo Chan et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. www.thelancet.com Published online January 24, 2020 https://doi.org/10.1016/S0140-6736(20)30154-9.
Jeanne Brugère-Picoux
Professeur honoraire de pathologie médicale du bétail et des animaux de basse-cour (Ecole nationale vétérinaire d’Alfort), membre de l’Académie nationale de médecine, présidente honoraire de l’Académie vétérinaire de France

La maladie de Borna (du nom de la ville de Borna en Allemagne) est connue depuis le XVIIe siècle chez les chevaux et les moutons. L’intérêt pour la maladie de Borna s’est accru en médecine vétérinaire à partir de 1993 suite à la découverte d’autres espèces sensibles (chat, autruche, bovins, chien…) et de son extension géographique (Etats-Unis, Suède, Israël, Japon...). En 2000, avec la collaboration du centre de référence sur la maladie de Borna de Berlin (Pr Hans Ludwig, Institut Robert Koch), nous avons signalé la présence de ce virus et de ses anticorps chez 73 chevaux français [1]. La même année, l’équipe de notre confrère S. Zientara rapportait également la présence d’anticorps chez des chevaux français [2].
A cette époque, on ne connaissait qu’un seul virus de la maladie de Borna, dénommé Mammalian 1 orthobornavirus ou BoDV-1. La maladie, caractérisée par des troubles nerveux dus à une méningo-encéphalite, est surtout connue en Allemagne, en Autriche et en Suisse et elle est souvent asymptomatique. La persistance de ce virus dans l’environnement est liée à un réservoir infecté permanent, la musaraigne bicolore (Crocidura leucodon) [3]. Depuis un peu plus d’une décennie, d’autres bornavirus ont été décrits chez des oiseaux Passeriform 1/2 bornavirus, Psittaciform 1/2 bornavirus, Waterbird 1 bornavirus) puis chez des écureuils («variegated squirrel bornavirus 1» ou Mammalian 2 orthobornavirus ou VSBV-1). Contrairement aux bornavirus aviaires, ce VSBV-1 hébergé par des écureuils exotiques (écureuil multicolore ou Sciurus variegatoides et écureuil de Prévost ou Callosciurus prevostii), identifié en 2015, a provoqué des encéphalites mortelles chez l’Homme en Allemagne (cf. Ecureuil multicolore et écureuil de Prévost : risque zoonotique lié au bornavirus VSBV-1, publié sur ce site en 2017). Ces cas d’encéphalites ont peut-être réactivé les discussions sur le rôle zoonotique potentiel de la maladie de Borna, surtout soutenu par l’équipe de l’Institut Koch de Berlin [4] considérant que certains troubles psychiatriques pouvaient être provoqués par ce virus. Si l’origine virale des troubles psychiatriques a toujours été très difficile à démontrer et était très controversée, la démonstration récente de cas d’encéphalites mortelles liés au BoDV-1 en Allemagne, notamment en Bavière, démontre que la maladie de Borna s’avère effectivement une zoonose à surveiller.
Après que trois publications aient signalé pour la première fois l’émergence des premiers cas d’encéphalite mortelle provoqués par le BoDV-1 en 2016 chez trois personnes immunodéprimées après une greffe [5] et deux autres cas non transplantés [6,7], Niller et al. [8] ont recherché le BoDV-1 dans les prélèvements cérébraux réalisés en Bavière entre 1999 et 2019, soit 56 cas mortels d’encéphalites humaines pouvant être d’origine virale. Huit malades se sont révélés positifs, dont deux cas d’immunodépressions après transplantation d’organe. Deux cas supplémentaires ont été identifiés à Munich.
Les symptômes rapportés ont été principalement une migraine et une hyperthermie suivies de signes neurologiques (troubles de la démarche, confusion, perte de la mémoire, convulsions puis progressivement perte de la conscience conduisant à un coma profond et à une perte des réflexes du tronc cérébral. Les patients sont décédés dans les 16 à 57 jours suivant leur admission à l'hôpital. Chez sept patients, l'analyse initiale du LCR a révélé une augmentation du nombre de leucocytes : 9-343 leucocytes par μL (normal : < 5 leucocytes par μL). Seuls les huit patients positifs lors de la recherche du virus possédaient des anticorps (IgG) dans leur LCR et leur sérum. Ces anticorps étaient parfois indétectables lorsque les patients étaient admis à l'hôpital mais augmentaient rapidement par la suite.
Les patients vivaient dans des zones rurales ou suburbaines et leurs activités auraient pu les mettre en contact avec des musaraignes infectées, en particulier les patients propriétaires de deux chats qui leur amenaient régulièrement des petits mammifères, y compris des musaraignes.
Ces huit nouveaux cas d’encéphalite mortelle associée à une infection zoonotique par le BoDV-1 dans le sud de l'Allemagne entre 1999 et 2019, avec les six cas précédemment publiés, suggèrent que cette encéphalite virale, bien que relativement rare, doit être recherchée dans les zones d'endémie à BoDV-1, en particulier chez les patients immunodéprimés. Le risque de transmission iatrogène par transplantation d'organes doit être aussi considéré.
[2] Galabru J. et al. Borna disease virus antibodies in French horses. Vet. Rec., 2000, 147, 721-722.
[3] Hilbe M. et al. Shrews as reservoir hosts of Borna disease virus. Emerg. Infec. Dis., 2006, 12, 675-677.
[4] Ludwig H. et Bode L. Borna disease virus: new aspects on infection, disease, diagnosis and epidemiology. Rev sci tech Off int Epiz, 2000,19, 259-288.
[5] Schlottau K. et al. Fatal encephalitic Borna disease virus 1 in solid-organ transplant recipients. N Engl J Med, 2018, 379: 1377–79.
[6] Korn K. et al. Fatal encephalitis associated with Borna disease virus 1. N Engl J Med, 2018, 379 1375–77.
[7] Coras R. et al. Severe bornavirus-encephalitis presenting as Guillain-Barré-syndrome. Acta Neuropathol, 2019, 137, 1017–19.
[8] Niller H.H. et al. Zoonotic spillover infections with Borna disease virus 1 leading to fatal human encephalitis, 1999–2019: an epidemiological investigation. Published on line January 7, 2020, https://doi.org/10.1016/S1473-3099(19)30546-8.
Alain Delacroix
Professeur honoraire, chaire "Chimie industrielle - Génie des procédés" du Conservatoire national des arts et métiers

De nos jours, la mode est au bio et au naturel. On mange végétarien, végane, flexitarien, «fructivore», «insectivore», etc. L’adjectif chimique est devenu très péjoratif et cristallise toutes sortes de peurs plus ou moins rationnelles. Pourtant la chimie, qui est la science de la transformation de la matière, est liée à l’origine de notre existence, et l’industrie chimique est la mère de toutes les industries. La méconnaissance de ce domaine, effective ou simulée, est alimentée par les médias, où la peur garantit l’audience.
Mais les plantes ont fait de la chimie avant nous et cette chimie est-elle aussi inoffensive qu’on veut le croire ? Les plantes créent des molécules pour croître mais aussi pour se défendre de leurs prédateurs ; ces molécules sont toxiques et se cachent dans les légumes et les condiments que nous consommons tous les jours. Nous allons en donner quelques exemples.
Le citron, outre l’acide citrique qui abîme les dents, contient des furocoumarines, dont le psoralène, agent photosensibilisant qui augmente le risque de mélanome. Son cousin, le bergaptène, présent dans le zeste des agrumes, doit être éliminé, par distillation, des huiles essentielles de citron ; cette opération, qui est à la base du génie chimique, rend cette huile moins naturelle ! On a montré aussi que ces molécules présentes dans le pamplemousse perturberaient l’assimilation de nombreux médicaments.

Le céleri, qui ne ressemble pourtant pas à un agrume, contient également des furocoumarines, qui conduisent à des dermatites chez les agriculteurs et les transformateurs de ce légume. Il peut donc être dangereux de s’exposer au soleil après avoir consommé du céleri. Il contient aussi des nitrates, qui se transforment en nitrites dans la bouche. Ces nitrites naturels ont évidemment les mêmes propriétés que ceux qu’on ajoute dans la charcuterie et qui sont classés cancérigènes probables !
La tomate, considérée longtemps comme une plante ornementale, est consommée depuis relativement peu de temps (tout comme la pomme de terre). Elle contient de l’alpha-tomatine, un glycoalcaloïde toxique, davantage présent dans les tomates vertes. Quand la tomate est trop mûre, elle peut se couvrir de moisissures naturelles qui produisent de la patuline, petite molécule très toxique pour les animaux à sang chaud, dont l’homme.
Que se passe-t-il lorsqu’on prépare une salade de tomate ? On ajoute du vinaigre, qui est de l’acide acétique dilué, du sel, de la moutarde et peut être du poivre ou du piment.
Le sel, qui est du chlorure de sodium contenant beaucoup d’oligo-éléments, s’il est naturel, doit être un peu enrichi en iode pour éviter goitre et crétinisme et en fluor pour protéger les dents.
La graine de moutarde contient quant à elle de la sinigrine (qu’on trouve aussi dans les choux de Bruxelles et les brocolis). Lorsque la graine est écrasée, la sinigrine est dégradée en isothiocyanate d’allyle, qui donne son goût piquant à la moutarde et qui défend aussi la plante contre les herbivores. L'isothiocyanate d’allyle est moyennement toxique mais, pur, il doit être manipulé avec précaution.
![]()
Ajoutons du piment dans notre salade. Il contient de la capsaïcine, poison mortel en grande quantité – sa dose létale LD50 est inférieure au mg/kg par injection chez la souris. On prend moins de risques en mettant du poivre, la pipérine qu'il contient ayant une dose létale nettement inférieure.

Que se passerait-il si l’on avait fait le choix de se préparer une salade de pommes de terre ? Celles-ci contiennent de la solanine, qui est un glycoalcaloïde toxique, qu’on trouve particulièrement dans sa peau et ses yeux. La solanine provoque des effets inquiétants mais rarement mortels. La pomme de terre consommable en contient moins de 25 mg/100 g, mais cette concentration augmente si la pomme de terre est exposée longtemps à la lumière ou stockée au froid.
Continuons notre repas avec du poisson aux épinards. Ceux-ci contiennent des nitrates et de l’acide oxalique. Les nitrates, comme on l’a vu, se transforment en nitrites dans la bouche. Ils peuvent alors réagir avec les amines du poisson pour produire des nitrosamines très cancérigènes. Quant à l’acide oxalique, il est présent dans de nombreuses plantes que nous consommons (rhubarbe, oseille, etc.) ; il peut provoquer des problèmes rénaux et est mortel à hautes doses.
Ces exemples, parmi beaucoup d’autres, nous montrent que la chimie que font les plantes est très complexe et rarement inoffensive. Notre corps lui-même en rajoute car la chimie qui se produit dans notre bouche, notre estomac et notre intestin (qui est un magnifique réacteur de type presque piston !) est fort complexe aussi.
Rappelons aussi que la nature nous offre de somptueux poisons, dont la ricine, la toxine botulique, les aflatoxines et autres alpha-amanitine… sans compter tous ceux, à effets plus longs, que l’on obtient en cuisant nos aliments : acrylamide, amines aromatiques polycycliques…
En conclusion, cette chimie que font les plantes n’est pas bonne par nature et seule la science permet de faire la part des choses.

